阿斯利康(AZN.US)旗下PD-L1单抗完成审批,即将在中国上市
本文来自微信公众号”医药观澜“。
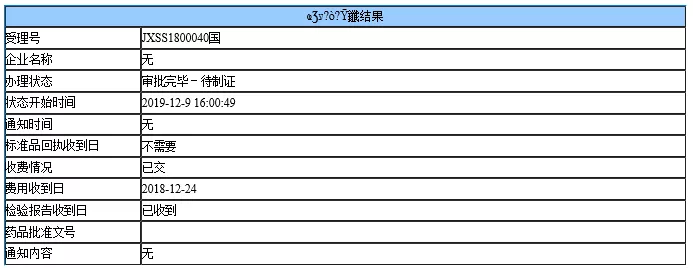
今日,业内传来重磅消息。阿斯利康(AstraZeneca)(AZN.US)旗下PD-L1免疫检查点抑制剂durvalumab(德瓦鲁单抗,商品名Imfinzi)在中国国家药监局的审评状态已更新为“审批完毕-待制证”状态。这意味着,这款药物有望成为中国首款获批的PD-L1抗体药物。当前,新型免疫检查点的抗肿瘤药物是全球药物研发热点,而中国大陆(不包括港澳台地区)尚无PD-L1单抗药物获批上市,今天的消息意味着,中国首款获批的PD-L1治疗药物有望花落阿斯利康。
图片来源:CDE截图
Durvalumab是一款PD-L1免疫检查点抑制剂。2017年5月,美国FDA加速批准了durvalumab用于局部晚期或转移性尿路上皮癌,同时批准的还有PD-L1检测试剂盒-SP263,用于检测PD-L1的表达。此次获批基于一项单臂临床试验,在182位患者中,有31位患者的肿瘤明显缩小,包括5位患者肿瘤完全消失。研究人员还根据PD-L1的表达状态分析了客观缓解率,结果显示,95例PD-L1表达水平较高的患者的客观缓解率为26.3%,73例PD-L1表达水平低或无表达的患者的客观缓解率为4.1%。
2018年2月,FDA批准durvalumab用于罹患3期非小细胞肺癌(NSCLC)的患者,此前该药在NSCLC上适应症还曾获得FDA授予的突破性资格。在一项713名非小细胞肺癌患者参与的3期临床试验中,结果显示durvalumab治疗组中位无进展生存期(PFS)为16.8个月,对照组仅为5.6个月。
2018年12月,阿斯利康向中国递交PD-L1单抗durvalumab的上市申请获得CDE承办受理。目前,durvalumab还以研发代号为MEDI4736在药物临床试验登记与信息公司平台共登记了9项临床试验,针对非小细胞肺癌、局限期小细胞肺癌、尿路上皮癌、肝细胞癌等适应症的多项研究正在进展中。
目前全球共上市3款抗PD-L1全人单克隆抗体,包括阿斯利康的Imfinzi(durvalumab),罗氏的Tecentriq(atezolizumab),以及德国默克和辉瑞联合开发的Bavencio(avelumab)。在中国,罗氏和阿斯利康的PD-L1在中国申报上市,另有辉瑞、基石药业、恒瑞医药、康宁杰瑞等企业的候选药正在开展3期临床。
祝贺阿斯利康PD-L1抗体药物在中国完成审批,即将上市。希望这款药物能够造福更多患者。
(编辑:余光捷)



 扫码下载智通APP
扫码下载智通APP