展望千亿MM适应症治疗市场,天境生物(IMAB.US)菲泽妥单抗创新研发取得关键性进展
近年来,免疫疗法改变了癌症的治疗模式,抗PD-1/PD-L1等免疫检查点抑制剂(ICIs)在癌症治疗中的重要性日益增加,大大改善了患者的预后和生存率。
但另一方面,全球每年癌症发病率还在不断攀升,加上肿瘤治疗本身极为复杂,临床上仍有未满足治疗需求,尤其是针对复发或难治性癌种,后线治疗手段捉襟见肘,如多发性骨髓瘤(MM)就是一大典型。如若针对该项适应症的治疗进度取得最新进展,往往能引发全球业界的广泛关注。
10月13日,天境生物(IMAB.US)宣布其在研新药CD38抗体菲泽妥单抗联合来那度胺作为二线疗法治疗多发性骨髓瘤的3期注册临床试验已完成全部患者入组,踏出攻克多发性骨髓瘤的关键一步。
智通财经APP了解到,多发性骨髓瘤是一种起源于骨髓浆细胞的恶性血液瘤疾病,侵袭性强,是一种易引起广泛骨质破坏、反复感染、贫血、高钙血症、高粘滞综合症及肾功能不全等一系列临床表现的恶性肿瘤。
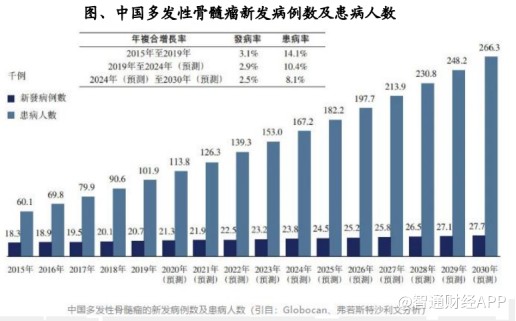
据统计,当前全球共有约75万名MM患者,每年新增病例约16万,呈逐年上升之势。
虽然针对这一顽疾,全球已有数十款上市治疗品种,但即便如此,仍有不少患者无法取得理想的生存获益,尤其对于那些存在特定细胞遗传学异常的MM高危患者而言,由于在复发后缺少有效的后续治疗选择,往往被迫深陷绝境。
根据梅奥骨髓瘤分层与风险调适治疗共识指南中的定义与统计,MM高危患者占到全部患者总数的20-30%,临床未满足需求极为突出,而这也衍生出一个庞大的适应症治疗市场。
数据显示,全球MM治疗市场规模将从2018年的194亿美元增长至2030年的473亿美元,中国MM治疗市场规模将从2018年的6亿美元增长至2030年的39亿美元。
虽然MM治疗市场规模庞大,但目前国外仅有3款治疗MM的抗体药物获批,分别是强生的达雷妥尤单抗、BMS和艾伯维的埃罗妥珠单抗、赛诺菲的Isatuximab;其中仅强生的达雷妥尤单抗国内获批。
总的来说,国内多发性骨髓瘤的可用药非常有限,较美国差距明显,鉴于国内此病的发病率和现存病例增长明显,目前亟需疗效性和安全性更佳的新药物。
而天境生物的菲泽妥单抗极有可能凭借不俗的疗效以及更短的用药时间成为国内第二款用于治疗MM的抗体药物。
据智通财经APP了解,在此前奥地利和德国针对患有复发性或难治性多发性骨髓瘤(r/r MM)的成年患者进行的临床1/2a期研究结果表明菲泽妥单抗的安全性和有效性良好。
在有效性方面,菲泽妥单抗与低剂量的地塞米松、泊马度胺/地塞米松、来那度胺/地塞米松联合治疗的客观缓解率(ORR)分别为28%、48%、68%。地塞米松、泊马度胺/地塞米松联合治疗的无进展生存期(PFS)分别为8.4个月、17.5个月。
在安全性方面,菲泽妥单抗首次给药采取两小时的静脉注射,在保证安全性的前提下,后续用药的注射时间可以缩短至30分钟。在所有的试验组中,91位患者中仅有18位(19.8%)发生输注相关反应(例如心跳加速、发热、过敏症)且反应程度大多比较温和。在与地塞米松联合用药组中观察到的IRR仅为7%(4/56)。
良好的初步临床结果,也让全球业界对此次菲泽妥单抗联合来那度胺作为二线疗法治疗多发性骨髓瘤的3期注册临床试验充满期待。
而且我们也注意到,近期根据国家药监局(NMPA)最新公示,杨森CD38单抗达雷妥尤单抗注射液(皮下注射)上市申请在中国获得批准,适应症为治疗原发性轻链型淀粉样变患者。而目前还未看到达雷妥尤单抗在做皮下剂型的多发性骨髓瘤适应症,跨适应症应用的话难度以及风险还是非常高的,所以也可以预见的是天境CD38的安全性和给药注射便捷性优势在未来一段时间将继续保持。同时作为中国市场的第二家CD38,身后无论是同靶点的竞争和生物类似药追赶者,距离上市均有一定的距离。
此次3期注册临床试验(NCT03952091)是一项随机、开放、平行对照的多中心研究,以菲泽妥单抗、来那度胺和地塞米松三药联合用药的无进展生存期(PFS)为首要终点,针对既往至少接受过一线治疗的复发或难治性多发性骨髓瘤患者人群,评估其与来那度胺和地塞米松双联方案相比的有效性和安全性。
该临床研究数据将支持天境在中国递交多发性骨髓瘤二线治疗的生物制品上市申请(BLA)。此项BLA申请按计划将于今年内递交。除此之外,菲泽妥单抗与另一款自研产品联用多发性骨髓瘤一线治疗的IND申请计划于年内递交,以布局多发性骨髓瘤的全线治疗策略。
除了多发性骨髓瘤适应症以外,天境生物还在积极探索CD38单抗在自身免疫领域的应用,其已在年中获得国家药品监督管理局(NMPA)药品审评中心(CDE)批准开展针对系统性红斑狼疮(SLE)的1b期临床研究。该研究将评估菲泽妥单抗治疗SLE患者的安全性、耐受性、药代动力学(PK)和药效学(PD)。
系统性红斑狼疮(systemic lupus erythematosus SLE)是一种系统性自身免疫病,以全身多系统多脏器受累、反复的复发与缓解、体内存在大量自身抗体为主要临床特点,如不及时治疗,会造成受累脏器的不可逆损害,最终导致患者死亡。具体病因尚不清楚,遗传、免疫、内分泌及环境等多种因素参与疾病进程(皮肤型红斑狼疮相对局限,脏器损伤相对轻微)。
美国患病率72.1 74.4/10万,中国患病率居世界第二(70/10万),约有患者100万,女性发病风险是男性的10倍。由于SLE对器官造成的损伤往往是不可逆的,疾病的早期诊治十分重要,但我国由于风湿免疫专科相对缺乏,患者临床表现异质性大,早期患者常因症状就诊而散落于不同科室,早期诊断困难。另一方面,SLE治疗药物有限,常规用药为糖皮质激素,治疗不规范或患者依从性不好常导致疾病反复,系统损伤呈进行性加重。
而公司的合作伙伴德国MorphoSys公司同时也正在开展两项菲泽妥单抗治疗膜性肾病的临床研究。可见菲泽妥单抗在多个适应症领域的应用潜力及广阔的市场前景。
实际上,除了全球业界对天境生物CD38抗体研发持续关注外,市场同样在密切关注并给予较高期望。据美国投行H.C.WainRight分析师预测,待天境生物菲泽妥单抗落地上市后,预计首年销售额3680万美元,而Jefferies分析师则预测2030年在多发性骨髓瘤适应症或将达到峰值6.93亿美元,能够显著丰厚公司的利润水平,为投资者带来更大的投资回报。



 扫码下载智通APP
扫码下载智通APP