2026年总销售额有望达71亿美元!这4款重磅炸弹有望年内获得FDA批准
2021年见证了FDA批准的多款令人印象深刻的疗法,如果说有一件事是毫无疑问的,那就是疫情不会影响生物制药公司将自己的产品在该机构最后审批期限之前推向市场的能力。
在备受争议中Biogen阿尔茨海默病新药Aduhelm获得历史性加速批准。安进(AMGN.US)的Lumakras更是在其密切关注中获得FDA提前批准,这款药物是全球首个批准的针对曾被认为是“不可成药”KRAS突变的肺癌疗法。
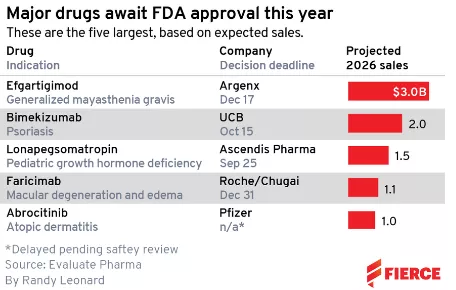
但是这场竞赛还没有结束,根据Evaluate Pharma数据,来自Argenx(ARGX.US)、UCB(UCBJY.US)、辉瑞(PFE.US)和罗氏(RHHBY.US)等公司的 4 款潜在重磅炸弹仍有希望在2021年底获得FDA批准上市。据Evaluate估计,到2026年,这些药物的总销售额累计约为71亿美元。
Evaluate年中报告中的另一款重磅炸弹为Ascendis Pharma的长效生长激素 lonapegsomatropin-tcgd,这款药物今年8月下旬获得FDA批准。商品名为Skytrofa,2026年的销售额预计将达到15亿美元。
对于其余的竞争者来说,获得FDA的批准并不是完全有把握。首先,辉瑞的abrocitinib(阿布昔替尼)可能面临更多阻碍,因为FDA在对Xeljanz(托法替布)进行调查后,对其他JAK抑制剂提出了新的安全警告。UCB的bimekizumab、罗氏的faricimab等候选药物即使获得批准,也将面临激烈竞争。
根据Evaluate,以下为2021年FDA尚未做出的最具价值的审批决定:
N0 1:Efgartigimod
接下来几个月FDA有望做出批准决定的药物中,最有市场前景的是Argenx公司的efgartigimod,用于治疗重症肌无力(gMG),gMG是一种导致肌肉功能丧失的自身免疫性疾病。FDA将在12月17日做出审批决定。
如果获得批准,efgartigimod将成为首个获得FDA批准的抗FcRn单抗。Evaluate预计efgartigimod将在2026年为其带来30亿美元收入。这家比利时公司预计它将领先于重量级的FcRn竞争对手三年时间,如:强生收购的Momenta Pharmaceuticals、阿斯利康收购的Alexion Pharmaceuticals。
Efgartigimod旨在阻断免疫球蛋白G (IgG) 的保护受体FcRn。从而降低与几种自身免疫疾病有关的致病性IgG抗体。研究表明,与安慰剂相比,治疗第26周后efgartigimod能够更好地缓解症状,该项研究也是FcRn药物的首个积极III期结果。
此外,Argenx还试图扩展efgartigimod用于其他5个适应症,并在欧洲和日本递交治疗gMG的监管申请。
N0 2:Bimekizumab
10月15日,UCB(优时比)的bimekizumab将迎来FDA批准决定,上市后,这款治疗银屑病的单抗将会面临激烈竞争。
已有证据表明这款IL-17F/IL-17A单抗注射液将击败强生和诺华的重磅产品。Evaluate估计,到2026年,其销售额预计将达到20亿美元。
两项独立的研究表明,UCB的bimekizumab在重度斑块状银屑病患者皮肤清除方面成功击败了强生的重磅炸弹Stelara和诺华的Cosentyx。
去年发表在《柳叶刀》杂志上的结果表明,在与Stelara头对头试验中,第16周时,bimekizumab组85%的患者银屑病面积和严重程度指数(PASI)至少下降90%,59%的患者达到皮肤症状完全清除。
而Stelara治疗组仅有一半的患者达到PASI 90%和皮肤症状完全清除。 基于这些结果,分析师估计,如果该药物能在与Cosentyx的头对头研究中有相同表现,那么它的前景将非常乐观。bimekizumab确实做到了。
8月份发表在《新英格兰医学杂志》上的结果表明,第16周时,bimekizumab组62%患者达到皮肤症状完全清除,而Cosentyx组这一数值接近50%。然而,bimekizumab与较高的轻中度口腔念珠菌病或口腔真菌感染发生率有关。
当然,UCB在院外可能还会面临其他竞品。有人担心在激烈的银屑病市场争夺中,艾伯维的Skyrizi和Humira、礼来的Taltz、安进的Otezla等可能因庞大的营销预算战胜bimekizumab。此外,百时美施贵宝和辉瑞的更多竞品也即将参与进来。
N0 3:Faricimab
在大流行期间,拜耳和再生元凭借其重磅炸弹眼科药物Eylea安然度过了这场风暴,甚至还扩大了市场份额。
如今,罗氏希望凭借其寄予厚望的双特异抗体faricimab扭转颓势,FDA正在评估faricimab用于湿性年龄相关性黄斑变性(AMD)和糖尿病黄斑水肿(DME)的疗效,预计将在今年年底前做出决定。
这家瑞士制药公司已经证明,faricima至少可以与去年全球排名第六的畅销药相媲美。4项III期临床研究表明,这款靶VEG和Ang2的双特异性抗体的效果非劣效于Eylea,并且faricima组患者用药间隔更长。
在整个试验中,约有一半的患者使用faricimab能坚持4个月,而使用Eylea只能坚持2个月。鉴于药物需通过眼内注射,这可能会给罗氏带来优势。
即使这样,faricimab仍不足以赶上再生元目前的领先优势。据Evaluate估计,faricimab 2026年的销售额为11亿美元,远低于Eylea目前的销售额。
N0 4:Abrocitinib
如今,联邦调查局终于结束了对辉瑞Xeljanz长达几个月的调查。而针对JAK抑制剂的又一波审批决策也将到来,其中就包括大型制药公司的另一款特应性皮炎药物abrocitinib。
鉴于不利的调查结果,分析师们预计,这可能会对JAK市场造成很大影响,而abrocitinib是否会受到影响目前尚未知。FDA最近对Xeljanz、艾伯维的 Rinvoq和礼来的Olumiant提出了新的心脏安全和癌症警告,一些分析师预计 abrocitinib也可能会出现类似的警告。
Evaluate估计,到2026年,abrocitinib将达到重磅炸弹级别,销售额可能达到10亿美元。而这仅是辉瑞对其潜在收入峰值预期的三分之一。
过去,监管机构出于安全考虑拒绝了其他JAK抑制剂的上市申请,包括吉利德类风湿性关节炎产品filgotinib。辉瑞和FDA都没有就调查结果是否会阻碍abrocitinib的批准做出说明。
尽管如此,abrocitinib在接受FDA审评过程中仍收获了好的消息。8月下旬,辉瑞表示,abrocitinib在第2周和第4周消除患者瘙痒和湿疹症状方面超过了赛诺菲和Regeneron的Dupixent,关于其安全性的关键细节仍然未知。
本文选编自“医药魔方Info”,作者:拾贝;智通财经编辑:李均柃



 扫码下载智通APP
扫码下载智通APP