2021下半年,这16款重磅新药将在国内获批
时间飞快,2021 年已过半。上半年经 NMPA 官宣批准的创新药有 16 款(不包括疫苗和中药),其中包括多个里程碑式的新药,如首个国产 ADC 维迪西妥单抗、国内首款细胞疗法阿基仑赛注射液、首个特异性 MET 抑制剂赛沃替尼等。
下半年,NMPA 还将批准哪些新药?
第 2 个 CAR-T?
第 7、第 8 、第 9 个 PD-1?
首个皮下注射 PD-L1 ?
据 Insight 数据库统计,下半年还有 16 款新药有望在国内获批,其中可能有 3 款国产 PD-1 获批加入激烈战局;同时,首个国产 PD-L1 可能会诞生;还有行业热议的 CAR-T 可能会迎来第二个入局者。这样看来,2021 年下半年也有蛮多看点的。
思路迪/康宁杰瑞 · 恩沃利单抗注射液
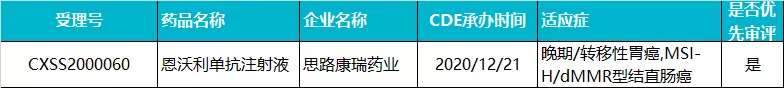
恩沃利单抗(KN035)是康宁杰瑞(09966)自主研发的一款重组人源化 PD-L1 单域抗体,2016 年起与思路迪医药共同开发,2020 年先声药业(02096)获得该药在中国大陆肿瘤适应症的独家市场推广权。
2020 年 12 月,恩沃利单抗在国内的上市申请获 CDE 受理,成为全球首个报产的皮下注射 PD-1/L1 抗体,适应症为微卫星高度不稳定(MSI-H)晚期结直肠癌和 MSI-H 晚期胃癌及其 DNA 错配修复功能缺陷(dMMR)晚期实体瘤。目前,恩沃利单抗正在中国、美国和日本完成和进行多个适应症的关键临床试验。
目前,国内只有阿替利珠单抗和度伐利尤单抗两款 PD-L1 单抗获批,都是通过静脉注射给药。此外,基石药业的舒格利单抗于 2020 年 11 月在国内报产,但其上市申请未被纳入优先审评,预计恩沃利单抗有望成为国内获批的第三款 PD-L1 单抗,全球首款获批的皮下注射用 PD-L1 单抗。
诺华 · 奥法妥木单抗注射液

奥法妥木单抗(ofatumumab)是 Genmab(GMAB.US) 开发开发的一款靶向 CD20 阳性 B 细胞的全人源抗体,2006 年授权给葛兰素史克(GSK.US),2009 年获 FDA 批准用于慢性淋巴细胞性白血病(CLL)患者,商品名为 Arzerra。2015 年,诺华(NVS.US)出资 10 亿美元从 GSK 获得奥法妥木单抗的经营权(研发代码 OMB157),开发作为新一代的 B 细胞耗竭剂。
2020 年 8 月,奥法妥木单抗被 FDA 批准用于治疗复发型多发性硬化症(RMS),包括成人临床孤立综合征,复发性疾病以及活动性继发性进行性疾病,商品名为 Kesimpta。成为第一个可以在家轻松给药和管理的 B 细胞疗法,采用 Sensoready 自动注射笔给药,每月一次皮下注射。
在国内,奥法妥木单抗于 2020 年 11 月在国内报产,随后被 CDE 纳入优先审评,拟定适应症成人复发型多发性硬化。
拜耳 · Vericiguat 片
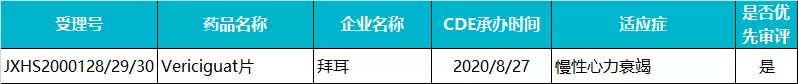
Vericiguat 是拜耳和默沙东(MRK.US)联合开发的一款每日口服一次的可溶性鸟苷酸环化酶(sGC)抑制剂。2021 年 1 月,该药被 FDA 批准用于射血分数<45% 的有症状的慢性心力衰竭患者,降低发生恶化心力衰竭事件,商品名为 Verquvo,成为首个获批治疗心力衰竭的可溶性 sGC 刺激剂。
目前,Vericiguat 已先后在美国、欧洲和日本获批。2020 年 8 月,该药在国内报产,随后被 CDE 以“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”为由纳入优先审评。
药明巨诺 · 瑞基仑赛注射液(暂定)
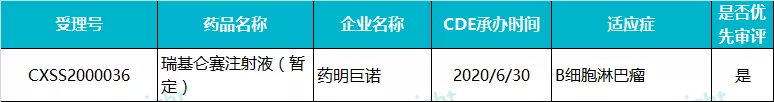
瑞基仑赛注射液(暂定)(JWCAR029)是药明巨诺(02126)在美国 Juno 公司 JCAR017 基础上开发的一款靶向 CD19 的 CAR-T 产品。2020 年 6 月,该药三线治疗弥漫性大 B 细胞淋巴瘤的上市申请被 CDE 受理,成为继复星凯特的益基利仑赛之后国内报产的第二款 CAR-T 产品。
在 2020 年 12 月举办的第 62 届美国血液病学会(ASH)年会上,药明巨诺公布了 JWCAR029 治疗复发性或难治性大 B 细胞淋巴瘤的关键性研究 RELIANCE 的数据。截止 2020 年 6 月 17 日,在 58 例可评估有效性的患者中,最佳客观缓解率为 75.9%,最佳完全缓解率为 51.7%。中位随访时间 8.9 个月,未达到中位 OS,6 个月 DOR、PFS 和 OS 分别为 60.0%、54.2% 和 90.8%。
目前,复星凯特的益基利仑赛已在国内获批,预计瑞基仑赛有望成为国内获批的第二款 CAR-T 产品。
3 款 PD-1 或跑步入场
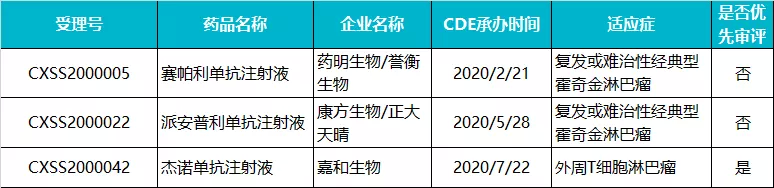
在国内 PD-1 异常激烈的时代,上述三个 PD-1 或许成为第二批入局者。从上市申请获承办时间来看,仅相差 2-3 个月,赛帕利单抗和派安普利单抗报上市的适应症都是霍奇金淋巴瘤,因为同类的产品已获批,所以并未走优先审评的流程。据 Insight 数据库显示,目前两款 PD-1 均已完成生产现场检查,且都处在第一轮发补资料中,截止发稿日,一个排队在 16 号,一个在 36 好,很有可能同一时间获批。
嘉和生物(06998)的杰诺单抗申报的是外周 T 细胞淋巴瘤,因为适应症与现有的 PD-1 差异化而被纳入优先审评,虽然申报时间略晚,但是当下进度最快,有望率先获批。
2021 年,国内上市的 PD-1 单抗产品有望达到 9 款。
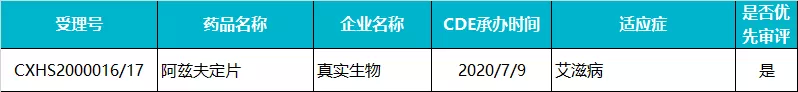
真实生物 · 阿兹夫定片
阿兹夫定(FNC)是全球首个艾滋病毒逆转录酶与辅助蛋白 Vif 双靶点抑制剂药物,为国内第一个拥有自主知识产权的抗艾滋病毒口服药物,曾获国家“重大新药创制”科技重大专项立项支持。
临床研究结果显示:FNC 口服剂量小(为阳性对照药物拉米夫定用量的百分之一),疗效显著。并且单次用药 4 天后仍能够 100% 抑制 HIV-1 复制的长效优势,有望成为未来暴露前 HIV-1 预防药物的首选。
2020 年 7 月,阿兹夫定在国内的上市申请获 CDE 受理,成为继艾博卫泰(前沿生物开发的一款 HIV 长效融合抑制剂,商品名艾可宁,每周注射一次)之后国内报产的第二款国产 1 类 HIV 新药,未来有望成为国内首款具有自主知识产权的口服抗艾滋病毒 1.1 类新药。
再鼎医药 · ZL-2401 对甲苯磺酸盐片/注射剂

ZL-2401 对甲苯磺酸盐,即甲磺酸奥马环素(omadacycline,Nuzyra),是一种新型四环素,其设计旨在克服四环素耐药性,具有广谱抗菌活性。该药由 Paratek Pharmaceuticals(PRTK.US)开发,2019 年 2 月被 FDA 批准用于治疗社区获得性细菌性肺炎(CABP)及急性细菌性皮肤和皮肤结构感染(ABSSSI)成人患者。
2017 年,再鼎医药(09688)与 Paratek Pharmaceuticals 达成合作协议,获得 ZL-2401 对甲苯磺酸盐在大中华地区(包括中国大陆、香港、澳门及台湾)的独家开发和商业推广许可权益。2020 年 2 月,ZL-2401 对甲苯磺酸盐在国内递交上市申请,随后被 CDE 以“具有明显治疗优势创新药”为由纳入优先审评。
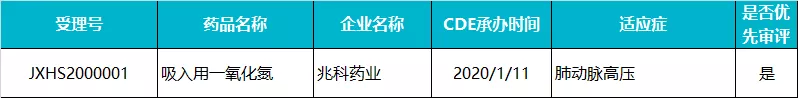
兆科药业 · 吸入用一氧化氮
吸入用一氧化氮(INOmax®)是一种血管扩张剂,可选择性地让肺血管放松,并通过配合换气装置及其他适当药物,改善脆弱新生儿群体的氧合。该药是全球首个医用 NO 气体,被 FDA 批准用于治疗患有低氧性呼吸衰竭 (“HRF”) 并伴随肺动脉高压的足月儿及 34 周以上的早产儿。在国内,吸入用一氧化氮于 2017 年被国家卫生部门纳入第二批鼓励研发的儿童用药清单。
吸入式一氧化氮是兆科药业旗下的重要产品之一,2020 年 1 月在国内报产,成为国内首个申请上市的吸入用气体制剂药品,随后该上市申请被 CDE 以“罕见病和儿童用药品”为由纳入优先审评。
协和发酵麒麟 · 注射用罗米司亭

罗米司亭(romiplostim,Nplate)是安进(AMGN.US)开发的一种第二代口服血小板生成素受体(TPO-R)激动剂,协和发酵麒麟拥有其在中国等地区的开发权。自 2008 年被 FDA 批准以来,Nplate 目前获批的适应症包括对皮质类固醇、免疫球蛋白或脾切除术应答不足的免疫性血小板减少症(ITP)成人患者,以及 ITP 持续至少 6 个月并且对皮质类固醇、免疫球蛋白或脾切除术应答不足的 1 岁及以上儿科患者。
目前,国内已经批准 4 款 TPO-R 激动剂,即三生制药(01530)的重组人血小板生成素、诺华的艾曲泊帕乙醇胺片、复星医药(02196)/AkaRx 的阿伐曲泊帕片以及恒瑞医药的海曲泊帕乙醇胺片。预计获批后,将加剧该类药物国内竞争格局。
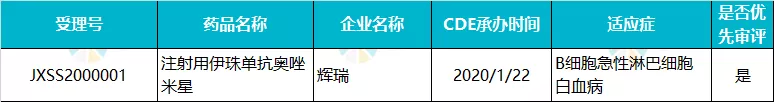
辉瑞 · 注射用伊珠单抗奥唑米星
伊珠单抗奥唑米星(Inotuzumab Ozogamicin)是辉瑞(PFE.US)和优时比联合开发的一款抗体偶联药物 (ADC),由靶向 CD22 抗原和单克隆抗体与一种细胞毒制剂卡奇霉素偶联而成,2017 年 8 月被 FDA 批准用于治疗复发或难治性前体 B 细胞急性淋巴细胞白血病(ALL),商品名为 Besponsa。
2020 年 1 月,伊珠单抗奥唑米星治疗复发性或难治性 CD22 阳性的急性淋巴细胞白血病(ALL)的上市申请被 CDE 受理,随后被 CDE 纳入优先审评范围。
GSK · 美泊利单抗注射液

美泊利单抗(mepolizumab,Nucala)是葛兰史素克开发的一款 IL-5 人源化单克隆抗体,通过与 IL-5 结合阻断 IL-5 与嗜酸性粒细胞表面受体的结合,而缓解重度嗜酸性粒细胞性哮喘,并同时降低嗜酸性粒细胞水平。
目前,Nucala 已在美国获批 3 个适应症,即重度嗜酸性粒细胞性哮喘(SAE)、嗜酸粒细胞性肉芽肿性多血管炎(EGPA)和嗜酸性粒细胞增多综合征(HES)。此外,该药治疗慢性鼻-鼻窦炎伴鼻息肉 (CRSwNP) 的补充新药申请也已被 FDA 受理。作为全球批准的首个 IL-5 生物疗法,Nucala 上市后销售额迅速攀升,2020 年高达 12.84 亿美元。
在国内,美泊利单抗的上市申请于 2020 年 7 月获 CDE 受理,随后被纳入优先审评审批程序,预计有望成为国内获批的首个 IL-5 生物制剂
华北制药 · 奥木替韦单抗注射液
重组人源抗狂犬病毒单抗注射液(rhRIG)是华北制药自主创新项目, 被列为国家“重大新药创制”科技重大专项品种。2007 年 6 月华北制药首次提交该药临床试验申请(200IU/瓶,500 IU/瓶两个规格),并于 2009 年 6 月获得临床试验批件。
2020 年 4 月,rhRIG 项目 III 临床结果显示,rhRIG 联合人用狂犬病疫苗对 III 级疑似狂犬病毒暴露人群的暴露后预防达到主要疗效和次要疗效终点,且安全性良好,达到方案设定目标。2020 年 7 月,重组人源抗狂犬病毒单抗注射液报上市,后被 CDE 纳入优先审评。
目前,国内尚无重组抗狂犬病毒单抗药物上市销售,国内可用于狂犬病毒暴露后预防的被动免疫制剂仅有抗狂犬病血清和狂犬病人免疫球蛋白。此外,兴盟生物自主研发的 1 类创新型生物制品 SYN023(重组抗狂犬病毒人源化单克隆抗体注射液)近期国内 III 期临床完成首例受试者给药,有望于 2021 年底在国内提交新药上市申请。
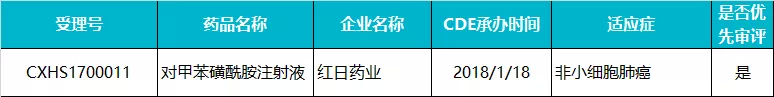
红日药业 · 对甲苯磺酰胺注射液
对甲苯磺酰胺注射液是国内外第一个通过肿瘤体内注射给药高效、广谱、低毒、特异识别染色的抗癌药物,由中国工程院院士、著名医学专家钟南山挂帅研发,目前针对晚期恶性表浅实体肿瘤、晚期肺癌、晚期肝癌和中央型非小细胞肺癌伴严重气道阻塞适应症的临床试验已经完成。
2012 年 4 月,北京健达康将对甲苯磺酰胺项目在中国的全部知识产权和所有权转入红日健达康,而红日健达康委托红日药业进行对甲苯磺酰胺原料药和对甲苯磺酰胺注射液的联合申报和生产。
2014 年 5 月,对甲苯磺酰胺注射液首次在国内递交生产申请,但后来在 722 临床数据自查中撤回。2018 年 1 月,该药在国内再次递交上市申请,随后被 CDE 纳入优先审评,适应症为严重气道阻塞的中央型非小细胞肺癌 。
微芯生物 · 西格列他钠片
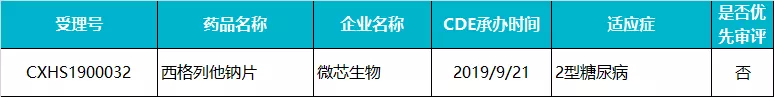
西格列他钠(商品名:双洛平)是微芯生物自主研发的已获全球化合物发明专利授权的核受体过氧化物酶体增生物受体(PPAR)全激活剂,属于全新作用机制的胰岛素增敏剂,用于治疗 2 型糖尿病。
作为全球首个完成确证性 III 期临床试验的 PPAR 全激动剂,西格列他钠在一系列临床研究中显示出显著且持久的降糖作用、显著的胰岛素增敏和血脂调控等综合作用,同时该药具有潜在的肝脏保护作用,有望为糖尿病及代谢综合征患者带来更多临床获益。
2019 年 9 月,西格列他钠治疗 2 型糖尿病的上市申请被 CDE 受理,预计将成为继西达本胺之后微芯生物获批上市的第二款产品。
整体看来,最主要的关注点还是在 PD-1 的新入局者,但是即使获批也已经错过了新一轮的医保谈判,对后续市场格局影响短期看不出,但更要关注的是后续差异化是否做得够好,背后的商业化团队是否给力。
另一个就是第二个 CAR-T 可能要获批,天价药物之间的竞争或许更让人期待。
本文选编自“Insight数据库”,作者:Dopine;智通财经编辑:庄礼佳。



 扫码下载智通APP
扫码下载智通APP