百济神州 (06160)PD-1 两大适应症即将获批!一线非鳞状 NSCLC、二线肝癌
今日,NMPA 官网显示,百济神州 PD-1 替雷利珠单抗两大新适应症上市申请(受理号:CXSS2000032/3)办理状态变更为在审批,即将在近日获批。这两项适应症分别为:联合化疗一线治疗晚期非鳞状非小细胞肺癌(NSCLC);既往接受过治疗的不可切除肝细胞癌(HCC)。
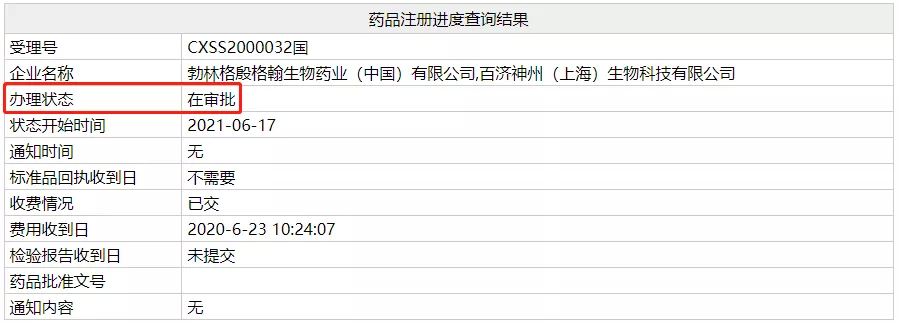
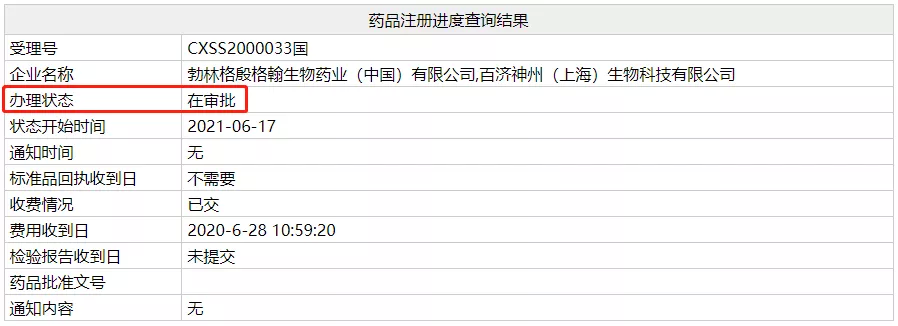
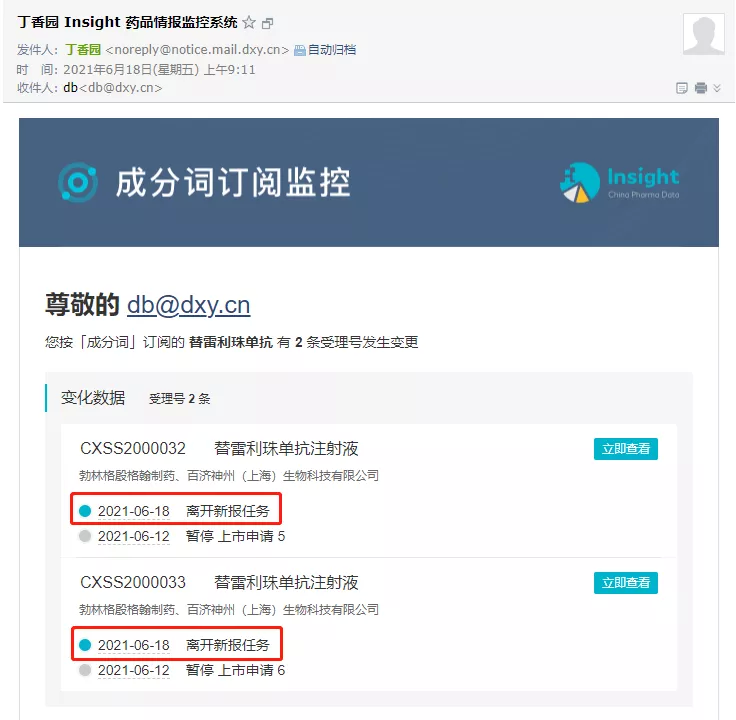
昨日早上,Insight 情报监控系统即已提示,这两项上市申请已离开新报任务队列。
一线非鳞状 NSCLC
肺癌是我国目前发病率和死亡率最高的恶性肿瘤,尤以非小细胞肺癌(约占 85%)为最。而在其中,非鳞状 NSCLC 所占比例高达近 65%。
在 2020 年 ESMO 大会及 2020 CSCO 大会上,百济公布了针对一线非鳞状 NSCLC 适应症的 3 期临床 RATIONALE 304 的数据。RATIONALE 304 研究(NCT03663205)是一项在中国人群中开展的随机、开放、多中心 III 期临床研究,评估替雷利珠单抗联合铂类与培美曲塞对比单纯化疗一线治疗 IIIB 或 IV 期非鳞状非小细胞肺癌(nsq-NSCLC)患者的有效性和安全性,共入组 334 名 nsq-NSCLC 患者。
ESMO 大会的中期分析数据显示,在晚期 nsq-NSCLC 患者中,相比单纯化疗,联合替雷利珠单抗治疗可显著改善 PFS,且具有更高的 ORR 和更长的 DoR。中位 PFS 从 7.6 个月提升到 9.7 月(P=0.0044;HR=0.645(95%CI:0.462-0.902)),ORR 达 57%(95%CI:50.6-64.0),中位 DoR 达 8.5 个月(95%CI:6.80-10.58),其中 CR 达 3.1%。
CSCO 会议上,RATIONALE 304 研究又进一步披露了研究者评估的 PFS 数据:8.7 个月(95%CI:7.62-11.63)vs 5.6 个月(95%CI:4.80-7.62),HR=0.561(95%CI:0.411-0.767),IRC 与研究者评估的 PFS 结果相似。
作为大癌种,肺癌是国内 PD-1 企业的必争之地。目前,帕博利珠单抗、信迪利单抗、卡瑞利珠单抗这 3 款 PD-1 均已获批联合化疗一线治疗非鳞状 NSCLC 适应症。随着百济神州替雷利珠单抗的获批,在该适应症领域竞争愈加激烈。
肝细胞癌(HCC)
2020 年 7 月,百济神州向 NMPA 递交替雷利珠单抗针对既往接受过治疗的不可切除 HCC 患者的 sNDA 并获受理。此项 sNDA 是基于一项关键 2 期临床试验(NCT03419897)的结果。该试验入组了来自亚洲和欧洲的 8 个国家和地区共 249 例不可切除 HCC 患者,其中 138 例患者既往接受过一项全身系统疗法,111 例患者既往接受过至少两项疗法。患者接受了百泽安®每三周一次、每次剂量为 200 mg 的治疗。该试验的主要终点为经独立评审委员会(IRC)评估的客观缓解率(ORR)。
目前,根据 Insight 数据库,国内包括百济神州在内共有 3 家 PD-1 申报肝癌适应症。恒瑞卡瑞利珠单抗在 2020 年 3 月已经获批二线治疗 HCC,信达信迪利单抗在今年 1 月申报了联合贝伐珠单抗一线治疗 HCC 的适应症,当前正在审评审批中。
根据 WHO 2020 年数据,肝癌是第六大常见癌症类型,在 2020 年全球约有 91 万例新发病例,也是癌症相关死亡的第三大原因,在 2020 年造成的死亡人数约为 83 万例。中国是肝癌大国,约占全球肝细胞癌(HCC)新发病例和死亡人数的 50%。而 HCC 是肝癌的主要类型,占所有报道肝癌病例的 85-90%。
替雷利珠单抗目前已有 3 项适应症获批。本次这两项新适应症如若获批,即拥有 5 项适应症。此外,百济还申报了二或三线 NSCLC、MSI-H/dMMR 实体瘤两项适应症,二线治疗食管鳞状细胞癌的适应症也即将报上市。
百济神州适应症申报情况(截至 6 月 18 日)
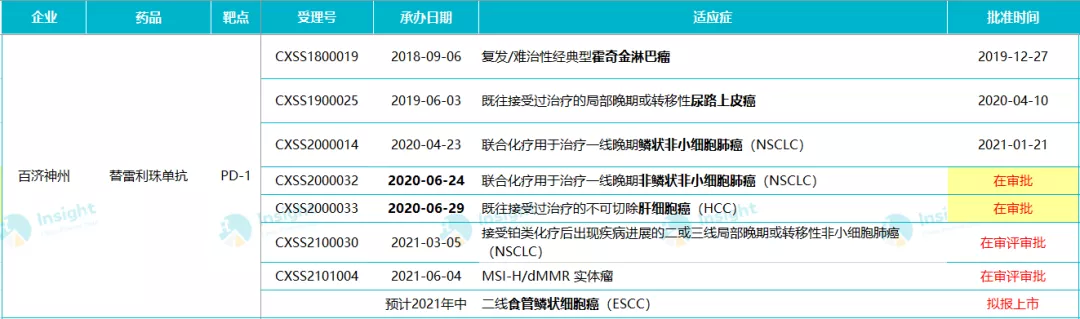
从临床开展来看,替雷利珠单抗在 CDE 登记了 27 项临床试验,尚有 14 项 3 期临床仍在进行中。
本文编选自“Insight数据库”;智通财经编辑:文文。




 扫码下载智通APP
扫码下载智通APP