2020年创新药获批最大赢家:诺华(NVS.US)
本文来自微信公众号“医药魔方”。
2020年,美国FDA共批准了53款新药,欧洲EMA共批准了42款新药,中国NMPA共批准了48款新药。本文将3个主要监管机构的新药批准情况作一汇总统计。
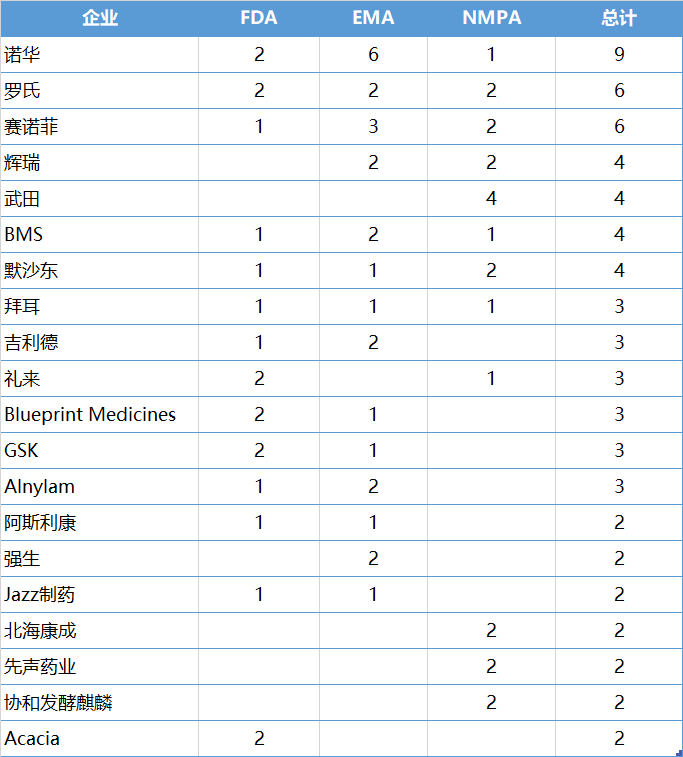
2020年,有20家企业收获2项以上的创新药批准。诺华是最大赢家,共收获了9项批准。其次是罗氏、赛诺菲,均有6项新药批准;武田、BMS、默沙东各有4项新药批准;拜耳、吉利德、礼来和Blueprint Medicines等各有3项新药批准。
2020年获批创新药数量最多的企业
NO.1 诺华(NVS.US)
诺华在2019年就是斩获新药数量最多的药企(10项),2020年能够再获丰收主要是欧洲地区的贡献,共有6款新药获得EMA批准。
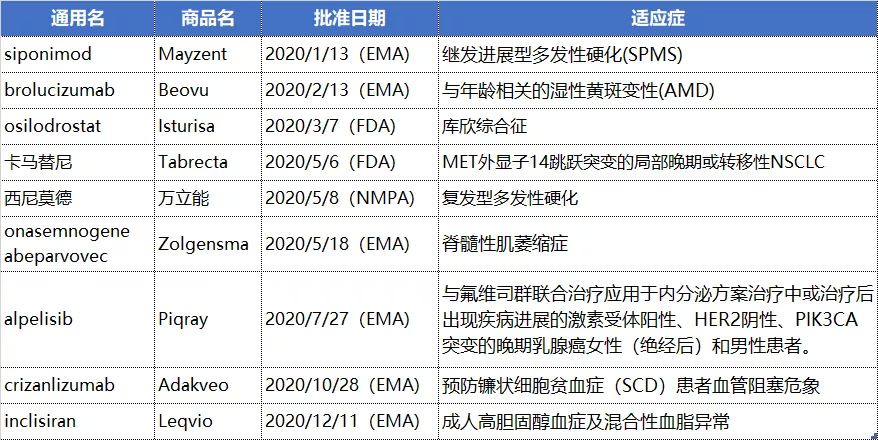
其中比较值得关注的新药包括治疗wAMD的新一代抗VEGF眼科药物brolucizumab(EMA批准)、降血脂RNAi疗法inclisiran(EMA批准)、治疗SMA的基因疗法onasemnogene abeparvovec(EMA批准),治疗多发性硬化的新一代S1PR调节剂西尼莫德(EMA、NMPA批准,日本也予批准),治疗非小细胞肺癌的c-Met抑制剂卡马替尼(FDA批准)、镰状细胞贫血症新药crizanlizumab(EMA批准)。
诺华不仅是2020年新药获批最大赢家,也是2020年医保目录更新的大赢家,共有8个新产品及新适应症通过医保谈判成功进入2020年版国家医保药品目录,4个产品成功续约。诺华对外披露自1987年以来共有超过80多个创新药物在中国获批;共计30个药物在最近3年被纳入国家医保目录;未来4年还将在中国提交50个新药申请。
NO.2 罗氏
罗氏2020年在欧、美、中三地分别收获2款新药。恩美曲妥珠单抗来到中国,成为中国首个批准的抗体偶联药物。阿替利珠单抗获得NMPA首次批准,参与到了中国的PD-1/PD-L1市场大战。
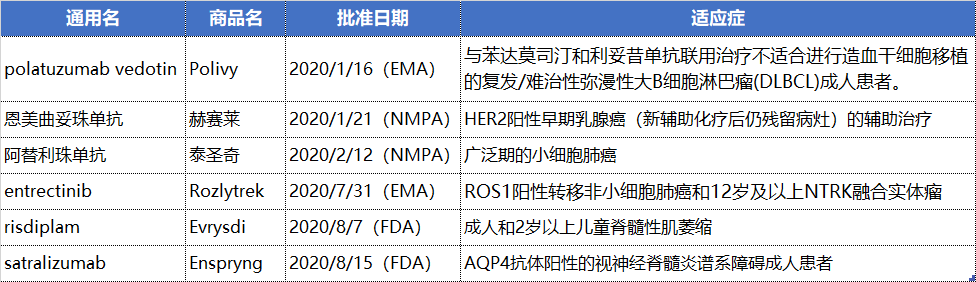
比较受关注的两款药物则分别是治疗1型脊髓性肌萎缩症(SMA)的口服SMN2基因剪接调节剂risdiplam,以及治疗视神经脊髓炎的IL-6R单抗satralizumab。
Risdiplam能够改变SMN2基因外显子7的选择性剪接,产生全长的SMN mRNA,从而表达功能性SMN蛋白。Risdiplam呈液体状态,可以口服或通过鼻饲管给药,能够持久地增加并维持整个中枢神经系统和机体外周组织的SMN蛋白水平,是首个也是唯一一个可以在家使用的SMA疗法。
Satralizumab是FDA批准的第一个用于治疗视神经脊髓炎的IL-6R抑制剂,采用了先进的再循环抗体技术,具有较长的半衰期也是第一个可以皮下注射的视神经脊髓炎药物,适合anti-aquaporin-4抗体阳性的患者,可以由患者自己或看护人完成注射,每四周一次。
NO.3 赛诺菲(SNY.US)
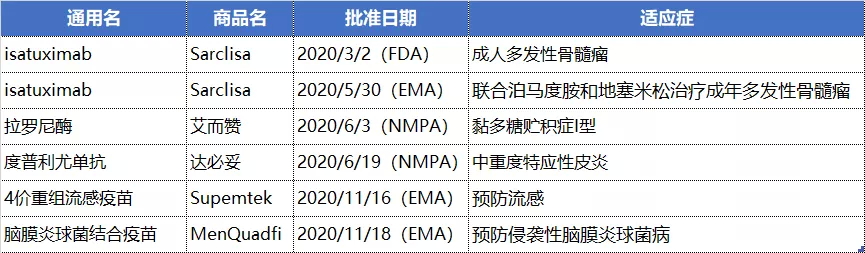
赛诺菲在中国拿下的两款新药分别是罕见病药物用于黏多糖贮积症I型患者的注射用拉罗尼酶浓溶液,以及治疗中重度特应性皮炎的度普利尤单抗注射液。度普利尤单抗是赛诺菲管线中的超级重磅产品,自2020年6月17日获批,已经通过2020年底的医保目录谈判进入国家医保目录,有望为赛诺菲提供业绩增长动力
NO.4 辉瑞(PFE.US)
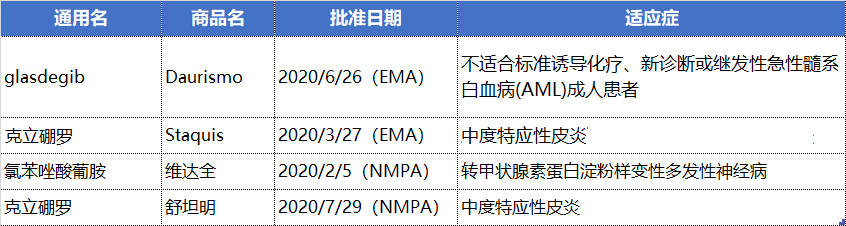
辉瑞在9月份召开的投资者会议上披露,其JAK1抑制剂abrocitinib、反义疗法vupanorsen和20价肺炎球菌结合疫苗可产生的峰值年收入将超过30亿美元;杜氏肌营养不良症基因疗法也有望超过20亿美元的峰值年销售额,以及另外6个年销售超过10亿美元的产品及5个可达到5-10亿美元年销售额产品。
预计到2025年,这些产品将为辉瑞带来150亿的销售额,以帮助其渡过2026年开始的下一波的专利到期潮。
NO.5 武田
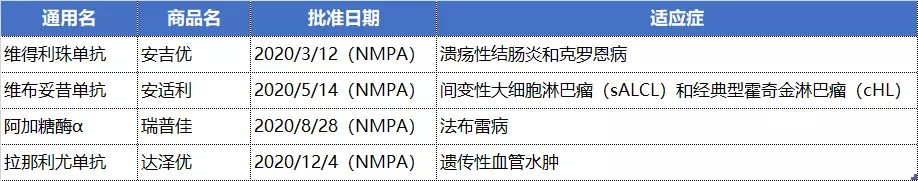
其中,维得利珠单抗被于2018年11月正式列入中国第一批《临床急需境外新药名单》,3月获批之后即通过了最新医保谈判,进入2020新版国家医保目录,中重度活动性溃疡性结肠炎(UC)或克罗恩病(CD)患者均可享受医保报销政策。此外,于2019年12月18日获批的反流性食管炎治疗药物富马酸伏诺拉生也进入新版医保目录。
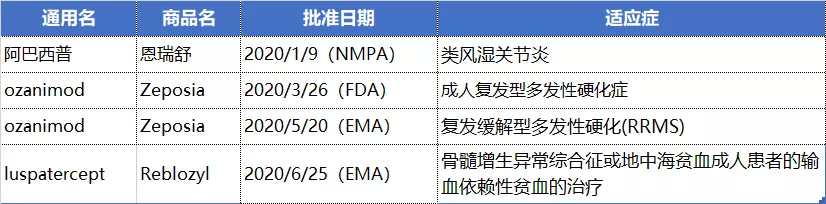
NO.6 BMS
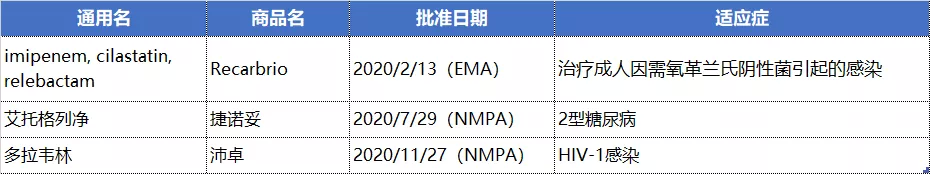
NO.7 默沙东(MRK.US)
默沙东2020年共收获3款新药,其中多拉韦林单药制剂于2020年11月获得NMPA的批准,用于与其他抗逆转录病毒药物联合治疗无NNRTI类耐药的HIV-1感染成年患者;2型糖尿病新药艾托格列净于2020年7月获得NMPA批准;此外EMA还批准了一款治疗成人因需氧革兰氏阴性菌引起的感染的复方抗生素。
NO.8 拜耳
拜耳2020年在欧、美、中各收获一款新药,分别是治疗非转移性去势性前列腺癌的达罗他胺、治疗美洲锥虫病的硝呋替莫以及治疗去势抵抗性前列腺癌的α-粒子辐射放射性治疗药物氯化镭 [223Ra] 注射液。
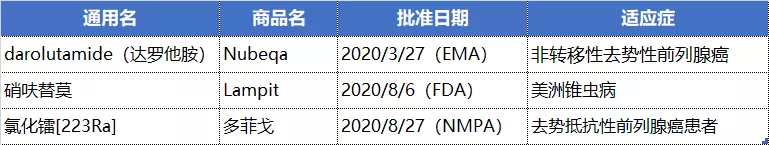
NO.9 吉利德(GILD.US)
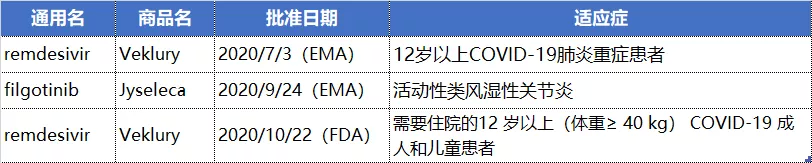
吉利德2020年最受关注的药物莫过于治疗COVID-19的瑞德西韦。该药物先后获得EMA和FDA批准使用。瑞德西韦是核苷类RNA依赖的RNA聚合酶(RdRp)竞争性抑制剂,是一种抗病毒药物。吉利德2020年获批的另一款药物是用于治疗活动性类风湿性关节炎的JAK1小分子抑制剂filgotinib。
NO.10 礼来(LLY.US)
礼来阿贝西利片于2020年12月29日获得NMPA的批准, 用于激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌。
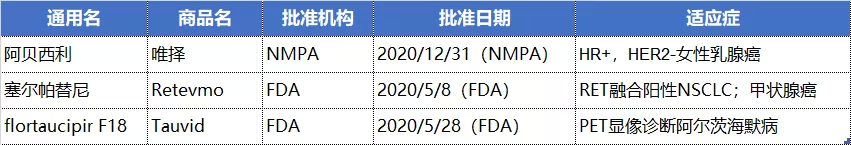
此外,礼来还在美国囊获2款新药,治疗RET融合阳性非小细胞肺癌(NSCLC)和甲状腺癌的塞尔帕替尼(Selpercatinib)以及PET显像诊断阿尔茨海默病的flortaucipir F18。
NO.11 Blueprint Medicines(BPMC.US)
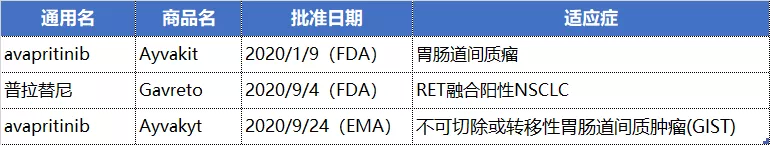
这2款药物的中国区商业化权益皆在基石药业手里,目前基石药业已经向 NMPA递交这2款产品新药上市申请。
NO.12 葛兰素史克(GSK.US)

NO.13 Alnylam(ALNY.US)
Alnylam制药公司是RNAi疗法开发领域的领军企业。该公司2020年共有2款药物拿下3项批准。1型原发性高草酸尿症新药lumasiran分别获得FDA及EMA批准,givosiran获得EMA批准用于治疗12岁及以上青少年急性肝卟啉症(AHP)。

Givosiran是一种皮下使用的N-乙酰半乳糖胺结合RNA干扰疗法,是继Onpattro(patisiran)之后第二款获得FDA批准上市的RNAi新药;而lumasiran则是继Onpattro(patisiran)、Givlaari(givosiran)之后的全球第三款RNAi疗法。
结语
在卫生事件成为全球焦点的2020年,全球主流药品监管机构的审评审批工作备受外界关注,FDA、EMA以及NMPA这3大监管机构不负众望,批准的新药数量在50款上下,与2019年基本持平。
从企业的纬度,跨国药企过去一年的新药获批个数明显高于国内药企和小型Biotech公司。以Blueprint Medicines和Alnylam制药为代表的美国Biotech公司因独特的技术开发的产品也受到了多个监管机构的认可,逐步走向市场。
(编辑:张金亮)



 扫码下载智通APP
扫码下载智通APP