三款新药拟纳入突破性治疗品种,来自诺华(NVS.US)、云顶新耀-B(01952) 和科济生物
本文来自 微信公众号“医药观澜”。
中国国家药监局药品审评中心(CDE)网站最新信息显示,三款新药拟纳入突破性治疗品种,分别是诺华(NVS.US)在研反义寡核苷酸(ASO)疗法TQJ230,云顶新耀(01952) 引进的IgA肾病在研药物Nefecon,以及科济生物BCMA靶向CAR-T细胞注射液CT053。
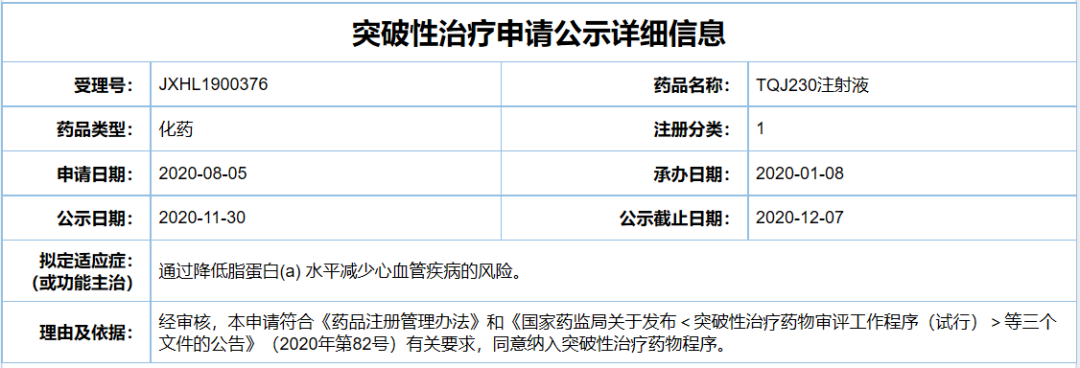
1、TQJ230注射液
公司:诺华
适应症:通过降低脂蛋白(a)水平减少心血管疾病的风险
TQJ230是一种使用Ionis公司的专有技术开发的反义寡核苷酸(ASO)疗法。它通过与表达Lp(a)的mRNA相结合,降低mRNA的水平,从而减少Lp(a)蛋白的表达水平。Lp(a)是血液中的一种脂蛋白。过高水平的Lp(a)会在血管中沉积,逐渐造成血管狭窄,并且限制对心脏、大脑、肾脏和下肢的血液供应。Lp(a)水平升高是一个独立的遗传性心血管疾病(CVD)风险因子,而TQJ230通过降低Lp(a)蛋白的表达,有望降低患者CVD风险。
此次TQJ230在中国拟纳入突破性治疗品种,拟开发适应症为通过降低脂蛋白(a)水平减少心血管疾病的风险。根据该产品此前已进行的2b期临床试验数据,TQJ230能够剂量依赖性降低Lp(a)的水平,98%的患者在接受TQJ230治疗后能够达到Lp(a)<50 mg/dL的正常标准。其两项3期临床试验分别将于2021和2024年获得结果。
截图来源:CDE官网
值得注意的是,TQJ230是诺华公司于2019年2月耗资1.5亿美元从Akcea Therapeutics公司获得的一款ASO疗法,也是诺华心血管研发管线中的重要产品之一。根据诺华早前发布的新闻稿,这款靶向RNA的创新疗法对于Lp(a)水平高的人群来说可能是革命性疗法。如果3期临床试验获得成功,预计TQJ230将成为行业领先的治疗选择。
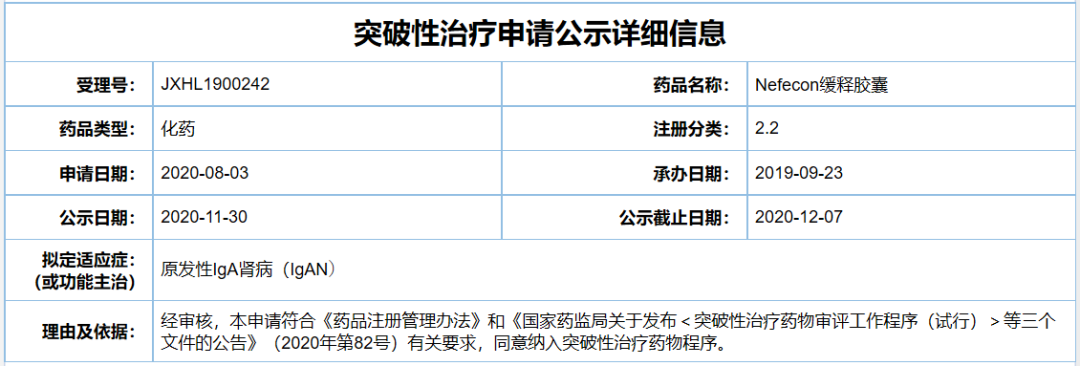
2、Nefecon缓释胶囊
公司:Calliditas Therapeutics/云顶新耀
适应症:原发性IgA肾病(IgAN)
Nefecon是Calliditas Therapeutics公司开发的一款布地奈德的口服靶向释放制剂,布地奈德是主要用于治疗哮喘和肠道疾病的抗炎药。2019年6月,云顶新耀与Calliditas公司签订了独家授权许可协议,获得了在中国(包括香港、澳门、台湾地区)和新加坡开发和商业化Nefecon的专属权利。此次该产品在中国拟纳入突破性治疗品种,拟定适应症为原发性IgA肾病(IgAN)。
根据公开资料,Nefecon的作用机制是将药物递送至患者疾病起源的小肠下部Peyer斑块区域。Nefecon源自TARGIT技术,该技术可使药物通过胃和肠道而不会被吸收,仅当其到达小肠下部时才被释放。此外,它的生物利用度非常低,即大约90%的活性物质在到达体循环之前在肝脏中被灭活。这意味着高浓度的药物在需要治疗的地方被局部使用,且只会产生非常有限的全身暴露和副作用。
截图来源:CDE官网
根据Calliditas公司在今年11月发布的数据,Nefecon在关键性全球3期临床试验NefIgArd A部分取得良好结果,达到试验主要目标:在治疗9个月后,患者的尿蛋白肌酐比率(或蛋白尿)在统计学上显著降低;在治疗12个月后,有了显著的持续性改善。该试验还达到了关键的次要终点——治疗9个月后,与安慰剂相比,患者肾小球滤过率估计值存在统计学上的显著差异。疗效数据也表明,在与进展为终末期肾病相关的关键因素上具有显著且有益的效果。此外,结果显示Nefecon的耐受性普遍良好。
基于这些临床试验数据,Calliditas公司计划在2021年上半年分别向美国FDA、欧洲EMA提交Nefecon的审批申请。在中国,云顶新耀也正在同步开展全球3期临床试验,以支持Nefecon在中国获批。
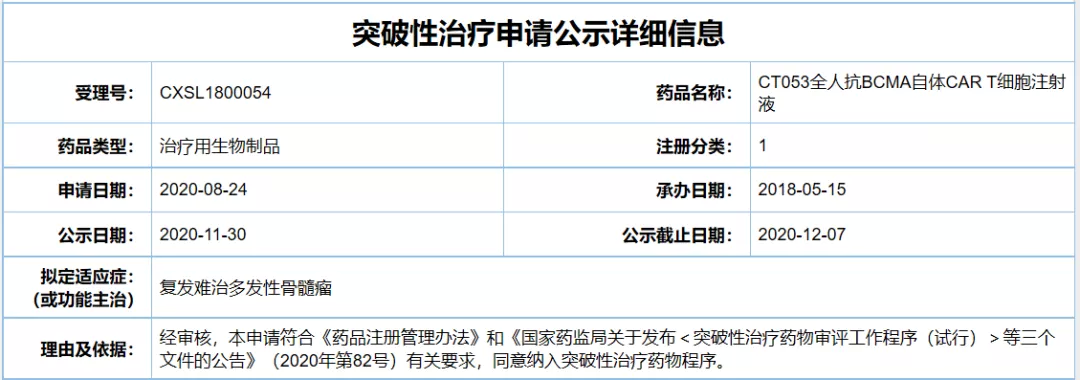
3、CT053全人抗BCMA自体CAR-T细胞注射液
公司:科济生物
适应症:复发难治多发性骨髓瘤(R/R MM)
CT053是由科济生物自主研发的创新疗法,采用全人抗体靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR)修饰的T细胞。此次CT053在中国拟纳入突破性治疗品种,主要目标适应症为R/R MM。根据公开资料,CT053此前已在治疗复发/难治多发性骨髓瘤患者的临床试验中达到87.5%的总缓解率(ORR)和79.2%的完全缓解率(CR/sCR)。
近日,科济生物还将在第62届美国血液学会年会(ASH)上展示CT053治疗多发性骨髓瘤最新研究结果,包括中国1期注册临床试验,中国探索性临床试验的24个月随访结果,以及北美1b期注册临床试验。这3项研究结果表明,CT053在中国和北美R/R MM患者中有一致的良好的耐受性,在经过多线治疗的患者观察到显著且持久的临床疗效,细胞在体内扩增良好,且未检测到抗药抗体(ADA)。
截图来源:CDE官网
根据科济生物早前发布的新闻稿,基于系列临床研究结果,CT053细胞有望成为治疗复发/难治MM有突破意义的产品。值得一提的是,此前CT053已经在中国、美国和加拿大获得临床试验批准,并获得FDA授予的再生医学先进疗法(RMAT)资格和孤儿药资格,以及欧洲药监局(EMA)授予的优先药物资格(PRIME)和孤儿药资格。
祝贺这3款新药在中国拟纳入突破性治疗品种,希望它们在后续临床开发中取得更多突破性进展,早日为患者带来临床获益。
(编辑:马火敏)



 扫码下载智通APP
扫码下载智通APP