嘉和生物港交所递表,3款在研产品即将递交上市申请!
本文来源于“医药观澜”微信公众号。
6月26日,嘉和生物在港交所提交上市申请,高盛集团、摩根大通和杰富瑞(Jefferies)担任其联席保荐人。据悉,该公司预计于未来12至18个月内将分别向中国国家药监局(NMPA)提交三项新药上市申请(NDA)及多项临床试验申请(IND)。

自2007年创立以来,嘉和生物的战略重点一直集中于主要治疗领域,这些领域在肿瘤、自身免疫及其他慢性病方面拥有大量未得到满足的医疗需求。今年6月1日,嘉和生物宣布完成1.6亿美元的B轮融资,现有股东高瓴资本继续领投,新的投资者包括淡马锡、华润正大生命科学基金、海通开元国际和Cavenham PE等。
嘉和生物在中国上海及美国旧金山建立了研究中心,并建立由15款靶向候选药物组成的产品管线,涵盖已知及新型生物学通路。目前,该公司在亚洲正在进行超过18项临床试验。
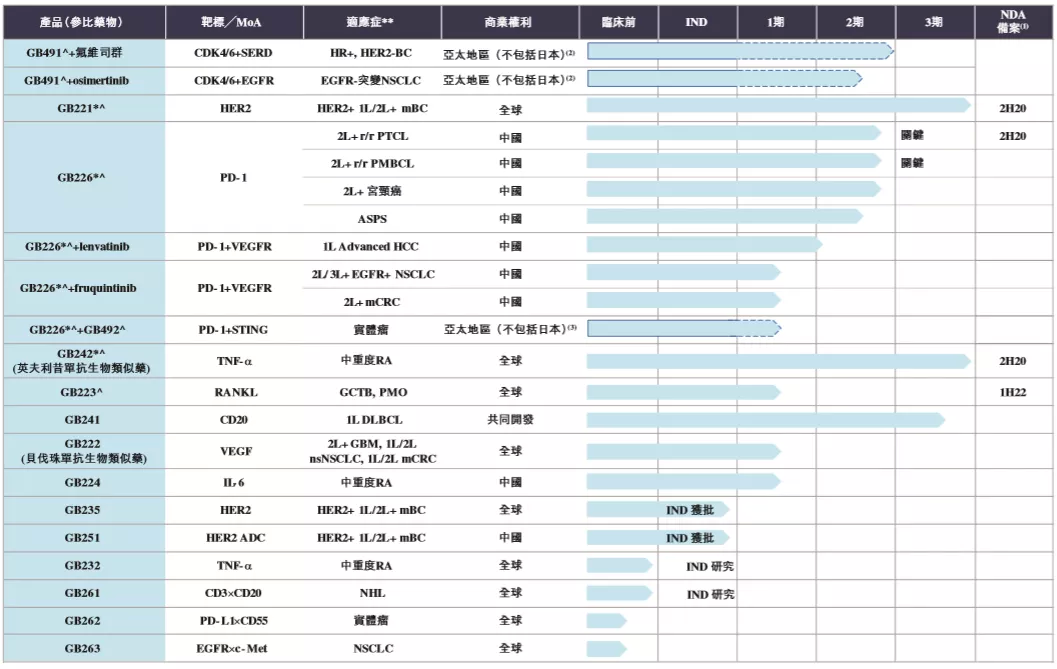
Lerociclib(GB491):由G1 Therapeutics公司发现和开发,6月22日,嘉和生物与该公司达成合作,将拥有lerociclib在亚太地区(日本除外)的专有开发和商业化权利。这是一种差异化的口服CDK4/6抑制剂,已开发用于与某些类型的乳腺癌和肺癌中的其他靶向疗法联合使用。该药在雌激素受体阳性,HER2阴性(ER+,HER2-)乳腺癌患者中的初步临床数据,已证明了其与目前市售CDK4/6抑制剂的差异临床特征的概念证明,在耐受性和中性粒细胞减少症方面有了很大的改善。中性粒细胞减少症是与CDK4/6抑制相关的主要毒性之一。目前,该产品正在开展两项1/2期临床试验。
GB221:一款重组抗HER-2(表皮生长因子受体2)人源化单克隆抗体,为赫赛汀(曲妥珠单抗)生物类似药。在已经完成的针对HER-2阳性乳腺癌患者的1期单次给药临床试验中,GB221显示出了良好的安全性,以及与赫赛汀相似的药代动力学特征;目前正在转移性乳腺癌中开展3期临床研究。预计将于2020年下半年在中国提交NDA。
GB226:一种靶向免疫细胞PD-1的人源化IgG4单克隆抗体,嘉和生物拥有核心知识产权。目前,该在研药正在中国进多项2期关键临床研究。嘉和生物计划将于2020年完成首次完成向NMPA提交用于治疗外周T细胞性淋巴瘤(PTCL)的NDA,这可能使GB226成为中国首款NDA获接纳的用于治疗PTCL的PD-1单抗。
GB492(IMSA101):为干扰素基因刺激因子(Stimulator of interferon genes,STING)激动剂,嘉和生物计划将其与GB226联合开发用于治疗实体瘤。在肿瘤环境中,STING是先天的主要介质癌细胞的免疫感应。多项研究显示,STING激动剂可与免疫检查点抑制剂(ICI)结合使用,作为新免疫刺激疗法,可增强癌症免疫週期的功效。IMSA101目前在美国在实体瘤患者中进行单药1期临床试验,或与ICI结合使用。该公司计划评估GB492与GB226结合在中国实体瘤中的应用情况。
GB242:为抗肿瘤坏死因子(TNF-α)抗体,英夫利西单抗生物类似药,是一款自身免疫性疾病用药。目前,嘉和生物正在对使用GB242治疗类风湿关节炎进行3期临床试验,并计划在2020年下半年前向NMPA提交NDA,并计划推断出英夫利西单抗其他获批准适应症。
GB223:重组抗RANKL人源化单抗究。目前,嘉和生物正在研发可用于治疗骨巨细胞瘤(GCTB)的GB223,目前正在中国进行GCTB治疗的1期剂量增加临床试验。同时,该公司正在启动GB223在绝经后骨质疏松症(PMO)的临床试验,并计划探索该产品在更广泛的骨质疏松症适应症中的潜在疗效。该公司计划在2022年上半年前向NMPA提交NDA。
根据招股书,嘉和生物此次在港交所申请上市,募集资金的主要用途包括用于GB491的计划临床试验及注册备案筹备,核心产品正在进行及计划中的临床试验、适应症扩大、注册备案筹备及潜在商业化,以及其他候选药物正在进行及计划中的临床试验等。
(编辑:文文)



 扫码下载智通APP
扫码下载智通APP