HQP1351申请上市实现国产三代格列卫“零突破” 亚盛医药-B(06855)步入估值提升“快车道”
国内首个“三代格列卫”落地在即,让市场的目光再次聚焦到亚盛医药-B(06855)。
智通财经APP了解到,6月18日亚盛医药宣布,公司已向国家药监局新药审评中心(CDE)提交HQP1351的新药上市申请,用于治疗伴有T315I突变的慢性髓性白血病(CML)慢性期和加速期患者。
这是亚盛医药创立以来的首个新药上市申请,HQP1351也有望成为国内首个上市的第三代BCR-ABL抑制剂。

身为中国生物创新药研发领域的领头羊,亚盛医药担负着业界和资本市场的双重期待。今年5月,公司核心产品HQP1351相继获得FDA孤儿药资格认定和快速通道资格(FTD),踏出通往国际商业化道路的关键一步。
此次HQP1351在国内提交NDA,充分说明公司在中国研发和商业化的步伐,也在有条不紊地向前迈进。
国际化开发为新药上市铺路
作为一家立足中国、面向全球的原创新药开发公司,亚盛医药一直都是以全球视角做药物的研究与开发。
亚盛医药董事长杨大俊博士此前多次强调,亚盛是要做中国自己的全球创新药。而全球创新有重要的两点,一是要有全球的专利保护;第二在开发过程中必须要按照国际的标准。
回顾HQP1351的开发历程,这款创新药物之所以能实现高效快速落地,正是得益于公司高标准的国际化开发策略。
智通财经APP了解到,亚盛医药一直大力推进产品在全球范围内的临床开发,通过中美双向联合,实现与国际接轨。HQP1351作为公司丰富产品管线中,研发进展最快的核心候选产品,国际化开发策略在其开发过程中有着充分体现。
国内开发方面,在此次递交NDA之前,HQP1351便已获得“一次性伞式批准”。这使得HQP1351作为单一疗法治疗TKI耐药性或伴有T315I突变的慢性髓性白血病CML患者,和TKI耐药复发/难治性胃肠道间质瘤GIST患者,以及两项伴有T315I突变的慢性髓性白血病慢性期和加速期的关键II期临床试验进度加快,为HQP1351最终提交上市申请做好了铺垫。
海外研发方面,去年7月,FDA审批通过了公司在美国开展治疗伴有T315I突变或TKI耐药慢性髓性白血病患者的Ib期临床试验申请,首名患者于今年1月开始用药。
而在今年5月,HQP1351相继获得FDA孤儿药资格认定和快速通道资格(FTD),说明该药的产品质量和临床效果已充分获得FDA的认可。在国内生物药研发和商业化逐渐与国际接轨的背景下,拥有FDA认证的权威背书,无疑能为HQP1351在国内的最终上市“加分不少”。
国际交流方面,HQP1351的开发一直紧跟国际最前沿的生物治疗动态。智通财经APP了解到,HQP1351 I期研究初步结果曾在2018年ASH年会入选口头报告,2019年其更新临床数据则再次入选ASH年会口头报告。连续两年入选ASH年会口头报告,充分显示了国际血液学界对HQP1351疗效和安全性的认可。
在全球化专利申请方面,截至2019年年末,公司已在全球拥有80项授权专利及200余项专利申请,其中约67项专利已在海外授权。在目前全球各大创新药企业加大研发投入,争夺技术专利的市场大背景下,积极进行全球化专利申请,能为公司HQP1351及后续产品的成功商业化奠定坚实的基础。
可见,亚盛医药强劲的投入,让HQP1351已经赢在了生物创新药国际化开发的起跑线上。
不过,在全球生物创新药高速发展的背景下,公司提升估值空间的核心要素,不仅仅在于强有力的技术储备和国际化的开发策略,明朗的商业化预期同样重要。
商业化竞争优势明显 未来成长确定性增强
中长期持有生物创新药公司,支撑投资逻辑的,除了公司强大的研发管线和研发实力,便是不断提高的市场天花板和产品的竞争优势。
如今,HQP1351在国内落地在即,对HQP1351未来市场空间和商业化潜力进行研判,有助于投资者深度了解亚盛医药投资价值的增长空间。
智通财经APP了解到,HQP1351作为一款针对格列卫耐药研发的第三代Bcr-Abl/KIT抑制剂,能够靶向不同种类的Bcr-Abl突变体,可以有效克服一代、二代BCR-ABL抑制剂的耐药缺陷。初步数据显示,HQP1351耐受性好,疗效显著,特别是对T315I突变的CML患者具有突出的疗效。此次,HQP1351便是以伴有T315I突变的慢性髓性白血病(CML)作为适应症在国内进行申报。
从市场规模的角度来看,全球范围内的CML市场规模在2030年将增至58亿美元,而在中国的CML药物市场到2023年市场规模将预计增长至142亿元。
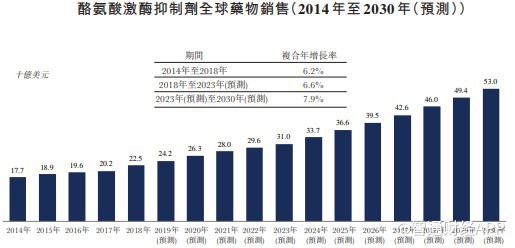
值得注意的是,目前国内关于CML治疗药物的可及性较差。国内CML治疗的药物选择较西方发达国家更少,目前真正上市的只有伊马替尼、尼洛替尼和达沙替尼。
而其它二代TKI如博舒替尼,以及首款三代TKI帕纳替尼,现均未在中国上市。尤其是对于耐药或疗效欠佳或进展期的CML患者,三代TKI应该是“刚需”,但国内目前尚缺乏该类药物。
也就是说,若成功在国内获批上市,HQP1351将成为国内首款上市的第三代BCR-ABL抑制剂,市场独占性优势明显。
由于其可以有效克服一代、二代BCR-ABL抑制剂的耐药缺陷,HQP1351一旦上市,势必能够满足国内CML治疗市场庞大且迫切的未满足需求,迅速抢占国内CML治疗的百亿市场份额,为亚盛医药带来丰厚的利润。
展望全球市场,达沙替尼和尼洛替尼,在CML的一线和二线治疗中已占据了重要地位。数据显示,这2款“二代格列卫”在2019年的销售额分别为21.1亿美元和18.8亿美元,总销售额达到39.9亿美元。
而在三代TKI的市场竞争方面,目前与HQP1351存在潜在竞争关系的药物之一,便是首款三代TKI产品帕纳替尼。智通财经APP了解到,武田的帕纳替尼,每年销售额水平都有数亿美元,在全球CML药物市场影响力较大。不过一旦毒副作用更低的HQP1351获批上市登陆国际市场,将具有更加强劲的市场竞争力,势必会抢占其全球市场份额。
综上所述,HQP1351在国内的商业化进程来看,亚盛医药已表现出巨大的先发优势,符合市场投资生物医药“独角兽”的核心逻辑。待HQP1351顺利获批上市,亚盛医药定能收获丰厚的利润回报,提升作为国产生物创新药龙头公司的估值溢价。



 扫码下载智通APP
扫码下载智通APP