阿斯利康(AZN.US)重磅ADC乳腺癌药物获得惊艳II期数据,2021年能在中国上市?
本文来自微信公众号“医药魔方”。
近日,阿斯利康(AZN.US)和第一三共在2019年圣安东尼奥乳腺癌研讨会(SABCS)和《新英格兰医学杂志》上同步公布了抗体偶联药物DS-8201(trastuzumab decuxtecan)治疗乳腺癌的II期结果(DESTINY-Breast01)。
该项单臂试验在全球入组184例HER2阳性乳腺癌患者。这些患者先前已经几乎用尽各种药物,包括恩美曲妥珠单抗(trastuzumab emtansine,100%)、曲妥珠单抗(trastuzumab,100%)、帕妥珠单抗(pertuzumab,65.8%)、其他抗HER2疗法(54.3%)、激素疗法(48.9%)以及其他系统疗法(99.5%),但仍然无法控制病情,可以说到了无药可治的绝境。然而针对这样的患者,DS-8201却显示出了良好的疗效:客观反应率达到60.9%,疾病控制率97.3%,12个月总生存率达到了86%。
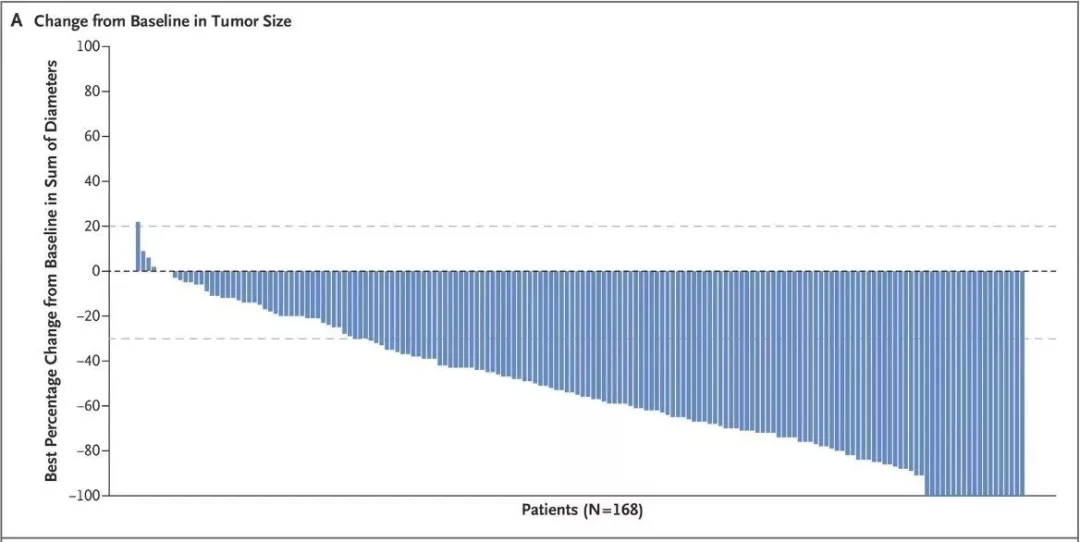
这个数据与DS-8201在I期研究中针对111例HER2阳性乳腺癌患者的临床结果基本一致(分别是59.5%和93.7%),充分说明了药物疗效可靠且稳定。虽然II期研究的应答持续时间和无进展生存时间相比I期研究有一定幅度减少,但14.8个月和16.4个月对于晚期癌症患者来说还是相当惊艳,更何况是各种治疗手段失败已经到了无药可治境地的HER2阳性乳腺癌患者。
DS-8201两项临床试验数据
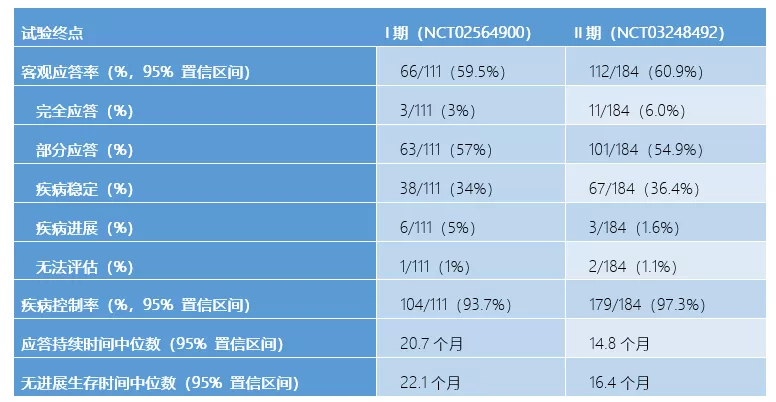
来源:1)10.1016/S1470-2045(19)30097-X ;2)10.1056/NEJMoa1914510
正是凭借如此突出的疗效,第一三共已经于2019年9月向日本PMDA提交了DS-8201上市申请,并获得了先驱疗法资格认定(Sakigake designation)。2019年10月,阿斯利康也向美国FDA提交了DS-8201的上市申请,并获得突破性疗法资格认定(Breakthrough therapy designation)。从审批进度上看,预计DS-8201在2020年3月和4月就能分别获得日本和美国药监机构的批准。
重磅交易,豪气十足
DS-8201凭借今年早期的一笔重磅交易已经走到了聚光灯下。2019年3月,阿斯利康和第一三共宣布联合开发DS-8201,为此将向第一三共支付13.5亿美元的预付款,以及高达55.5亿美元的里程金,交易总额共计69亿美元。阿斯利康与第一三共制药在全球范围内共同开发和商业化DS-8201,第一三共保留日本市场的独家权利,同时将全权负责制造和供应。
阿斯利康宣布这项69亿美元的交易时,DS-8201尚只有I期数据,距离上市还存在很大不确定性,可以说仍有较高开发风险。然而,DS-8201的I期临床数据实在是太诱人了,而且产品定位和阿斯利康的战略规划完全吻合。如此完美的标的怎能错过?哪怕前路仍然存在很大不确定性,哪怕要付出一大笔真金白银,也要果断出手。阿斯利康的勇气、魄力和专业决策令人佩服。
众里寻他,无可挑剔
为什么阿斯利康认定DS-8201是一个完美的产品?
从产品线来看,阿斯利康已经在乳腺癌领域耕耘了超过40年。从1977年历史上第一个靶向雌激素受体的乳腺癌内分泌治疗药物Nolvadex(他莫昔芬)开始,阿斯利康相继上市了3款乳腺癌内分泌治疗药物,分别是1987年的诺雷得(戈舍瑞林,一种合成的促性激素释放激素的类似物),1995年的瑞宁得(阿那曲唑,一种高选择性非甾体类芳香化酶抑制剂)和2002年的芙仕得(氟维司群,一种雌激素受体下调剂),覆盖了从早期到晚期、绝经前到绝经后的激素受体阳性乳腺癌患者。踩着恰到好处的节奏,陆续推出上述四个产品,成就了阿斯利康在乳腺癌内分泌治疗领域当之无愧的领导者地位。
不过此后很长一段时间里,阿斯利康在乳腺癌领域鲜有重磅产品推出,遭遇产品断档。直到2018年初,奥拉帕利在2018年初被批准用于治疗携带BRCA基因胚系突变、HER2阴性的转移性乳腺癌,阿斯利康总算是收获了乳腺癌领域的一个新品种。
反观乳腺癌领域的主要竞争厂家,罗氏在HER2阳性乳腺癌领域不断推陈出新,1998年推出曲妥珠单抗、2012年推出帕妥珠单抗,紧接着2013年推出恩美曲妥珠单抗。这三大HER2产品在2018年为罗氏带来了超过100亿美元销售额。更要命的是,MacroGenics公司研发的Fc结构域优化后增强免疫系统参与的Margetuximab已经从临床研究后期即将来到上市申请阶段。看着人家,怎能不嫉妒?
从肿瘤机制来看,阿斯利康在肿瘤基因驱动和耐药性、DNA损伤应答、肿瘤免疫治疗以及抗体偶联药物(ADC)展开布局。其中,肿瘤基因驱动和耐药性机制下有第一代EGFR抑制剂吉非替尼和第三代EGFR奥希替尼;DNA损伤应答机制下有PARP抑制剂奥拉帕利;肿瘤免疫治疗机制下有PD-L1抑制剂度伐利尤单抗。然而在ADC方面,却尚未有产品上市,而研发管线乏力。有此缺憾,怎能不心急?
在众多可选ADC药物标的中,为何DS-8201能让阿斯利康如此着迷?
首先,这是一个ADC产品,契合阿斯利康的管线规划,并且在开发阶段上有望迅速填补阿斯利康在这个领域的空白。
其次,DS-8201首要开发的适应症是乳腺癌。不仅适用于HER2阳性乳腺癌患者,就是对HER2低表达的患者,也同样表现出不错的效果。凭借着在乳腺癌领域的辉煌历史,和新近批准的奥拉帕利,完全可以重塑阿斯利康在乳腺癌领域的领袖地位。
最重要的是,DS-8201在HER2乳腺癌领域显示出了优势,不仅可以让阿斯利康拥有对抗罗氏三大HER2产品的资本,也有望凭借出色的临床数据反超原本在进度上处于领先的Margetuximab,让阿斯利康在HER2乳腺癌领域取得战略优势。
如果再考虑到罗氏三大HER2产品在2018年销售额超过100亿美元,那么大家可能就不会觉得69亿美元太贵了。
独特结构,成就经典
介绍了这么多,众人肯定十分好奇,这样完美的千金之躯到底是个什么样子呢?
10.1248/cpb.c18-00744
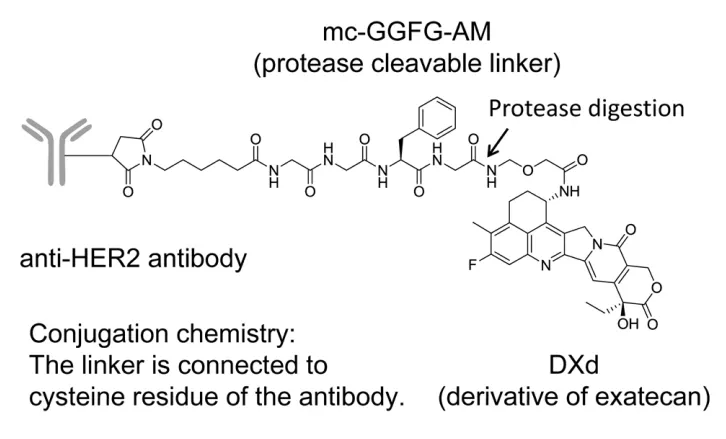
DS-8201设计巧妙,具有7大特点:1)全新高活性毒素;2)最高载药量;3)良好均一性;4)选择性酶切连接子;5)连接子与毒素结构稳定;6)毒素半衰期短;7)旁观者效应。
具体说来,抗体偶联药物DS-8201三大部分,除了经过20年临床实践的曲妥珠单抗之外,其设计奥妙之处就在于毒素和连接子。
先说说毒素。伊立替康是一种喜树碱类似物,因其广谱抗癌作用和细胞毒机制被用于治疗多种实体瘤。伊立替康进入体内后经羧酸酯酶作用转化为7-乙基-10-羟基喜树碱,从而发挥其抗癌作用。DS-8201所采用的毒素是一种全新分子,称为DXd,其抗癌活性是7-乙基-10-羟基喜树碱的10倍。相比恩美曲妥珠单抗(trastuzumab emtansine)中的毒素emtansine是紫杉醇和多柔比星这些传统化疗药物活性高出几十到100倍甚至1000倍,DXd毒性较低,避免误伤正常细胞。此外,毒素还具有良好的透膜性,可以穿透已经被杀死的癌细胞,继续杀死旁边围观的癌细胞,这就是所谓的旁观者效应。
对于DS-8201,每个单抗可以装载8个毒素DXd,这也是传统半胱氨酸偶联技术能够达到的最高载药量,而恩美曲妥珠单抗(trastuzumab emtansine)的载药量是3.5个毒素emtansine。之所以能够做到最高载药量,离不开特殊的连接子。DS-8201采用连接子的是一种酶切四肽(GGFG),有固定的氨亚甲基空间,相比传统对氨基苄基空间,可以降低疏水性,也能保证在体循环内保持稳定。
这样的ADC药物设计方式,不仅大幅提高疗效,也有助于降低副作用,或许会成为研发人员新的研发思路。
翘首以盼,何时进口
这样一个好药,中国老百姓最关心的事情就是什么时候可以批准进口。
医药魔方数据库显示,前面提到的I期和II期两项临床试验并没有在中国开展。目前国内正在进行的是两项国际多中心III期临床试验,都是在2019年启动。其中一项是针对HER2阳性乳腺癌患者,全球计划入组500例患者(NCT03529110),包括中国12家临床基地的60例(CTR20190378)。另一项针对HER2低表达乳腺癌患者,全球计划入组540例患者(NCT03734029),包括中国20家临床基地的81例(CTR20191730)。鉴于中国庞大的患者人群,在很短时间内完成患者入组并不是一件难事。不过,终点指标分别设计为45个月和3年,等到试验结束还需要等待漫长的时间。
显然,患者是等不起的。但是,可以在最早时间申请进口吗?通常来说,一个新药上市申请需要基于III期临床试验数据。不过,对于疗效突出且临床急需的新药来说,也可以采用II期临床试验数据。比如,目前DS-8201在日本和美国提交上市申请就是采取这种路径。国外如此,我国也同样可以这样操作。如2018年12月批准上市的PD-1抑制剂信迪利单抗,就是采用2期临床试验数据。此外,自从2015年开始的药品审评审批改革以来,国家药监局对于临床急需的进口新药,可以接受使用全球境外临床试验数据用于在中国进口注册的申请。如2017年批准进口的九价HPV疫苗,国家药监局只用了短短9天就给予有条件批准进口。
综合来看,国家药监局对临床急需的创新药给与优先审评和有条件批准,这条路径是可行的且有成功案例。因此,DS-8201完全可以在明年4月日本和美国批准上市后,以境外同样2期临床数据在中国申请有条件上市。日本人与中国人同属黄种人,也有充分的人种差异研究数据。同时,如果国内III期临床试验有数据更新,也可以滚动提交。考虑到阿斯利康中国区业务的亮眼表现,以及中国市场在阿斯利康全球版图中的重要地位,DS-8201最快于2021年上半年在中国上市也不是没有可能。
(编辑:张金亮)



 扫码下载智通APP
扫码下载智通APP