别想了,临床数据“共享”只会利好跨国药企
你无需大肆吸气,就能轻易嗅到医药圈里正涌起的一股热潮。
7月10日,CFDA发布《接受药品境外临床试验数据的技术指导原则》。这意味在《接受医疗器械境外临床试验数据技术指导原则》后,药品这端的口子也打开了。智通财经APP分析来看,该政策的下发,不仅会带动国内新药审批的速度,更会缩短国外新药进入中国的时间,利好跨国药企们。
而受宏观政策冲击,A、H两市的医药板块出现回调。截至7月11日收盘,A股医药指数跌近1个点;H股的药品板块微跌0.47%,基本上靠新股福森药业(01652)的22个点在支撑,多只细分领域的龙头均挂绿。
行情来源:富途证券
接受境外临床利好跨国药企
《接受药品境外临床试验数据的技术指导原则》文字虽然较多,但智通财经APP认为也就做了三个要点的布局:

一是确保数据真实、完整、准确、可溯源。该原则要求,申请人应确保境外临床试验数据真实、完整、准确和可溯源,这是基本原则。其数据的产生过程,应符合国际人用药品注册技术协调会(ICH)药物临床试验质量管理规范(GCP)的相关要求。
二是数据提交有规矩。该原则对于不同种类数据提交的要求进行了说明。在提交药品注册申请时,应按照《药品注册管理办法》的申报资料要求整理汇总境内外各类临床试验,形成完整的临床试验数据包。提交的数据应该包括生物药剂学、临床药理学、有效性和安全性资料数据。鼓励采用通用技术文件格式(CTD)提交。
三是数据质量决定接受程度。该原则依据临床试验数据的质量,将接受临床试验数据分为完全接受、部分接受与不接受三种情况。即完全接受的条件包括境外临床试验数据真实可靠,符合 ICH GCP和药品注册检查要求;部分接受数据存在影响有效性和/或安全性的种族敏感性因素,数据外推至中国人群的有效性和安全性评价存在较大的不确定性的;不接受数据存在重大问题发。另外,对于用于危重疾病、罕见病、儿科且缺乏有效治疗手段的药品注册申请,属于“部分接受”情形的,可有条件接受。
熟读细则不难发现,此次接受境外临床试验数据,并非一股脑地完全放开,属于系统分工。毕竟,为了加快境外新药在国内上市,我国一直在做系列尝试,而且这种尝试只会增不会减。
如6月20日,国务院召开的国务院常务会议明确提出, 我国将对治疗罕见病的药品和防治严重危及生命疾病的部分药品简化上市要求,可提交境外取得的全部研究资料等直接申报上市,监管部门分别在3个月、6个月内审结。此外,将进口化学药品上市前注册检验改为上市后监督抽样,不作为进口验放条件。
而同一时间,CFDA也宣布,将进一步简化境外上市新药审批程序、优化药品临床试验审批程序、取消进口药品逐批强制检验等政策,加快境外药品审评审批。对此,取消了进口化学药品的口岸检验,加强上市后的监督抽验。如此一来,进口化学药品从口岸通关后可直接配送至医疗机构、零售药店,将缩短进入中国市场时间2-3个月,大大降低境外新药进入中国市场的成本。
同样,该原则也将有望从机制上缩短境外新药在国内上市的时间,毕竟“数据”可以通用了。从某种层面,因为国内的技术差异,是异常利好国外创新药药企的。
国际化的药企也能沾光
当然,虽说整体更利好跨国药企,但国内一些走国际化的企业同样有机会,像绿叶制药(02186)、复星医药(02196)等。
智通财经APP就拿复星医药的注射用重组抗HER2人源化单克隆抗体为例,去年6月6日,复星医药发布公告,称控股子公司上海复宏汉霖生物技术股份有限公司到乌克兰卫生部关于同意注射用重组抗HER2人源化单克隆抗体于乌克兰进行III期临床试验的批准。
关于注射用重组抗HER2人源化单克隆抗体,智通财经APP曾也解释过,其实就是由罗氏研制,用于治疗HER2过表达的乳腺癌、转移性胃癌或食管胃交界腺癌的赫赛汀(曲妥珠单抗)的类似药。关于赫赛汀,美国还专门拍摄了一部名为《Living Proof》的电影,讲述了斯拉蒙开发该药物的故事。
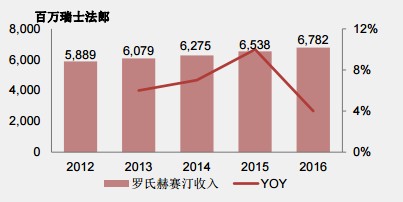
1998年9月25日,罗氏的赫赛汀(曲妥珠单抗)获得FDA批准上市,2002年9月5日进入中国市场。发展到2014年,其欧洲专利到期,美国专利也将在2019年6月到期。尽管专利即将到期,但罗氏依靠该药物每年获利近百亿美元。如2016年,该药物实现营收67.82亿瑞士法郎(约合70.34亿美元),同比增长4%,全球销售排名第8。
一个品种就能带来百亿美元的收入,如果能有一个,岂不是就可以赚翻了。所以,这也就解释了为何复星医药、丽珠医药(01513)、上海医药(02607)、三生制药(01530)等研发实力派会争先恐后地去启动开发方案,等待该药物的专利保护到期。
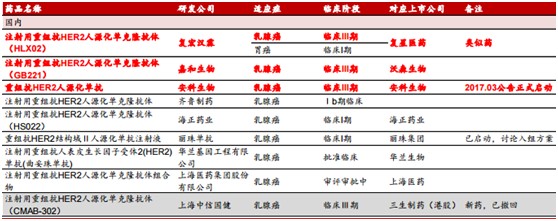
不过,就算国内竞争对手众多,复星医药却走在前列。资料表明,该公司自2015年7月便取得了用于转移性乳腺癌适应症的CFDA临床试验批准;2016年1月,该药用于转移性胃癌适应症已获CFDA的临床试验批准。经过一年发展,2017年1月,子公司复宏汉霖就该药用于转移性乳腺癌适应症向乌克兰卫生部递交了临床试验申请。
另外,之所以选择远赴乌克兰做III期临床试验,这或有两方面考虑:第一,国内的审批较慢,且因为专利问题就算通过III期临床试验,也无法上市,实现商业化;第二,乌克兰属于欧洲,赫赛汀(曲妥珠单抗)在欧洲的专利早在2014年便已到期,若该药第一时间通过III期临床试验,只要达到乌克兰相关的法规要求,便可在乌克兰上市,赚上几桶金,再通过国际化路线率先吃下中国市场,最终利好公司整体业绩。
而受益数据“共享”的出现,正好符合复星医药现在的发展战略。因此,该公司的HER2是有较大机会率先出来,成为政策受益者。(田宇轩/文)



 扫码下载智通APP
扫码下载智通APP