被列入预摘牌名单的亘喜生物(GRCL.US),一季报后从谷底回归?
去年1月,亘喜生物初登美股。上市当天,公司盘中股价大一度涨超50%,最终收涨31.89%,市值达到16.4亿美元。然而在过去的一年中,受中概股大环境以及生物医药行业风口转向的影响,亘喜生物(GRCL.US)股价出现持续下跌。
截至今年3月14日,公司股价盘中跌至每股1.68美元,也意味着公司市值正式跌至谷底。
不过,华尔街对追求前沿生物制药研发企业的估值判断,从来都是根据其研发进程随时做出改变。在经历了1.16亿美元市值谷底后,亘喜生物近期的市值仿佛有了触底反弹的迹象。截至5月16日收盘,公司市值回升至2.38亿美元。
在市值回升的背后,是亘喜生物近期通用型CAR-T研发取得进展。其重磅产品GC012F用于r/r MM患者治疗的首次人体试验研究结果将会在即将举办的2022年美国临床肿瘤学会(ASCO)年会及EHA 2022年会上同步发表。加之5月16日,亘喜生物公布了其2022年Q1季度未经审计财务业绩,不断增长的研发费用及较为充足的现金储备都给了市场以一定信心。
从财报看增长可持续力
因为缺乏造血能力,因此未盈利生物医药公司依赖融资已不是什么新鲜事。
从其自身角度来看,正常情况下,仅三期临床试验,可能就需要耗费3—7年时间,算上临床前研究及上市审批等时间,一款药物的成功上市平均需要5-10年的时间。也就是说,未盈利生物医药公司至少需要5年左右才能实现普遍商业化。
然而现实在于长周期的研发与较短的融资窗口期存在矛盾,也就使得现金自然成为这些公司度过融资寒冬的必要储备。对于亘喜生物而言,投资者关注的财务指标便不止其当期研发投入,还有其现金储备。
据智通财经APP了解,今年Q1季度,亘喜生物归属于普通股股东净亏损达1.58亿元(人民币,下同),较上年同期净亏损9970万元进一步扩大。一季度,公司研发支出为1.22亿元,上年同期为6540万元。增加的主要原因是研究、开发和临床试验支出增加,以及员工人数增加导致工资和人事费用增加,以及设施相关费用增加。
在现金储备方面,截至2022年3月31日,公司持有现金、现金等价物为16.21亿元,较上年同期减少了11.37%。
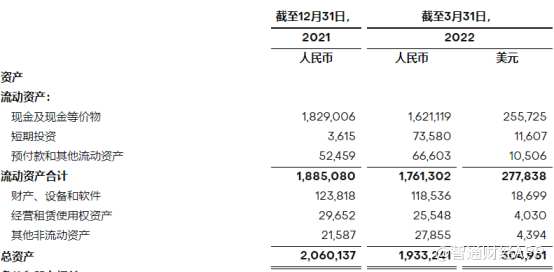
由此,投资者可以清晰看到,亘喜生物的现金储备与年亏损额比率从2021年Q1的18.47降至2022年同期的10.19。
值得一提的是,根据智通财经APP此前统计的港股部分18A企业的2021年年报,不少18A企业的现金储备与年亏损额比率已低于2,虽然这并不意味着药企真实的存续支撑时间,但这个数值小于两年,也绝对代表时间的紧迫性。
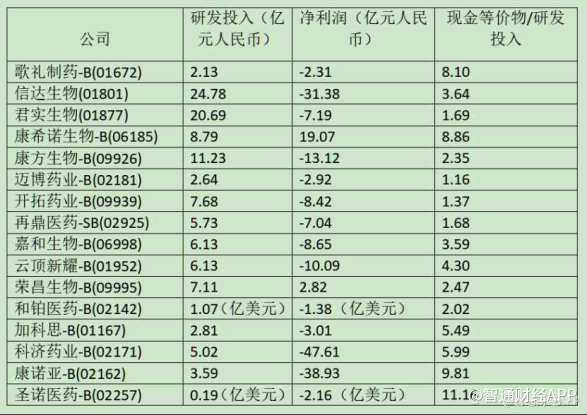
由此对比来看,亘喜生物的现金储备状况显然远在“现金红线”之上。
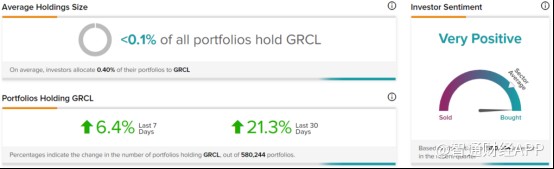
今年4月,BTIG分析师以买入评级和18美元的目标价开始覆盖亘喜生物,并指出公司当前在两个主要临床项目(GC012F和GC027)的拐点中都有足够的现金储备。在市场鲜有覆盖亘喜生物之时,不少投资者却对公司后续的增长潜力也表示了关注和积极态度。
最新披露数据或成估值增长跳板
从亘喜生物近期的股价走势来看,出现触底反弹迹象的日期大概是在4月20前后。这段时间正好是亘喜生物参加美国癌症研究协会(AACR)年会之后。
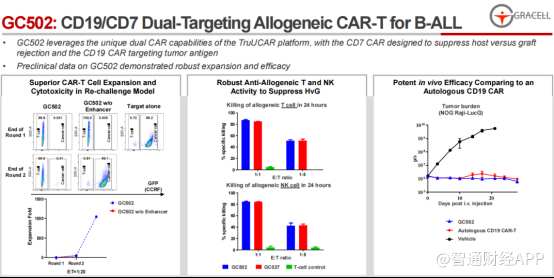
在今年AACR上,亘喜生物披露了其基于TruUCAR平台开发的高度差异化的候选产品:CD19/CD7双靶向CAR-T疗法GC502,针对复发/难治性急性B淋巴细胞白血病(r/r B-ALL)的首次人体试验(FIH)数据。
智通财经APP了解到,此次披露的初步临床数据显示出了GC502卓越的安全性和有效性。且值得一提的是,区别于目前已获批的CAR-T产品,GC502是一款通用型同种异体CAR-T疗法,意味着CAR-T或能逐步实现规模化生产,大大提高可及性和用药便利性的同时,对于病程进展迅速的患者,也能带来积极的临床获益。此外,其差异化设计能使其在特异性杀伤肿瘤的同时,更有效地避免同种异体细胞疗法天然存在的排异反应。
但对于市场来说,GC502最新数据的披露更像是“前菜”。因为在即将举办的ASCO2022年会及EHA 2022年会上,亘喜生物还将公布其核心产品GC012F用于r/r MM患者治疗的首次人体试验研究结果。这才是亘喜生物给国际学界送上的“主菜”。
GC012F是一款基于FasTCAR平台开发的双靶点自体CAR-T疗法候选产品。FasTCAR平台的技术特点在于,其可以解决自体CAR-T细胞最具挑战性的难题:如较长的制备时间、产品质量不理想和治疗费用高昂。通过将三条主要的制备路径(激活、转导、扩增)合为一条可同时发生的激活-转导路径,FasTCAR将2-6周自体CAR-T的制备周期缩短至隔天生产。并且FasTCAR还能增强T细胞的适应性和杀伤能力。
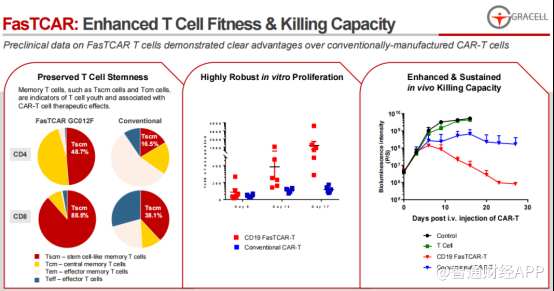
去年11月,GC012F获得FDA孤儿药资格(ODD)。另外财报显示,公司还计划于2022年下半年,在美国递交针对RR MM适应症的临床试验申请(IND),该进度根据CDMO合作伙伴的产能限制做出了相应的调整;还预计2022年在中国提交针对RR MM适应症的临床试验申请(IND)。
而此次公司在ASCO和EHA大会上公布GC012F的早期临床研究结果,则是该产品获得国际学界认可的重要过程。
据智通财经APP了解,该研究入组了3名中位既往治疗线数达2次的患者,所有患者均呈现高肿瘤负荷。截至2022年2月22日,3例入组患者均接受了GC012F的单次输注治疗,输注剂量分别为3.7x104细胞/公斤体重及2-3x105细胞/公斤体重。
所有3名患者在输注GC012F后的第28天,经PET-CT扫描确认均达到完全缓解(CR)。在3个月的随访中,2名可评估的患者得到了持续缓解。未观察到剂量限制性毒性及免疫效应细胞相关神经毒性综合征(ICANS)。2名患者出现了1级细胞因子释放综合征(CRS),1名患者出现3级CRS(持续2天),未出现4级或5级事件。
截至最新,全球还没有双靶点CAR-T获批上市,且亘喜生物同时布局了自体疗法和同种异体疗法的双靶点CAR-T,所以在不同技术平台下研发的产品良好临床数据首发或成为公司估值启动的重要信号。
不过,亘喜生物的股价除了要接受市场的考验外,似乎还要与时间赛跑。
智通财经APP了解到,5月4日,美国SEC将第六批88家公司列入《外国公司问责法》(HFCAA)的暂定名单,SEC要求这些进入“预摘牌”名单的企业递交证据以移除清单,截止日期为5月25日。其中亘喜生物赫然在列。
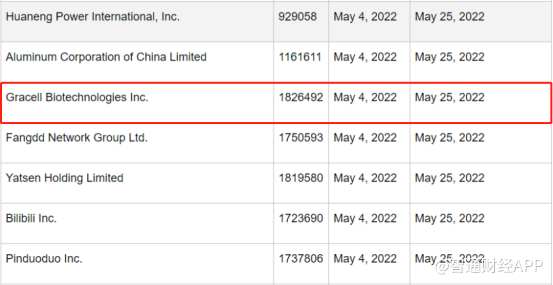
不过进入预摘牌名单并不意味着公司后续会被摘牌退市。根据现行版本的《HFCAA》,不遵守规定的公司将在2024年被摘牌。除了生物制药领域,该法案还影响了其他领域的100多家公司。
目前部分中概股公司已开始考虑相关对策。以天演药业为例,其在最近的季报中便公司将采取措施已符合HFCAA的要求。其在财报中提到,“天演药业正在积极评估其他业务流程和控制改变,以满足《HFCAA》的要求,并打算运用公司灵活的全球基础设施,专注于为全球患者开发高度差异化的治疗方法。
虽然目前亘喜生物也在预摘牌名单中,但华尔街似乎对这一负面信息反应并不强烈。在此信息公布后,亘喜生物的股价持续保持回升状态。



 扫码下载智通APP
扫码下载智通APP