罗氏(RHHBY.US)抗流感新药进入“在审批”状态,有望近期在中国获批
作者:
智通财经 玉景
2021-04-25 14:50:34
在中国,Xofluza的上市申请于2020年6月获得CDE受理,并被纳入优先审评。
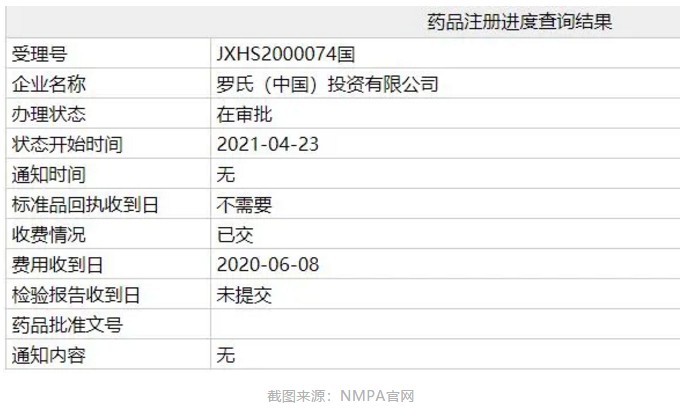
智通财经APP获悉,中国国家药监局(NMPA)药品注册进度查询结果显示,罗氏(RHHBY.US)提交的流感创新药玛巴洛沙韦片(baloxavir marboxil,英文商品名:Xofluza)办理状态已更新为:在审批,这意味着该药有望近期在中国获批。
Xofluza是由日本盐野义制药公司(Shionogi)和罗氏合作研发的一款“first-in-class”的单剂量口服药物。
2018年10月,Xofluza获得FDA批准上市,用于治疗12岁以上无并发症的急性流感患者,成为了近20年以来FDA批准的第一款具有创新作用机制的抗流感新药。2019年10月,FDA再次批准Xofluza的扩大适应症申请,用于治疗12岁及以上流感并发症高风险人群。2020年11月,Xofluza又获得FDA批准用于12岁及以上人群在接触流感患者后的流感预防(称为“暴露后预防”),新闻稿指出这是首个获批用于暴露后预防的单剂量流感药物。
在中国,Xofluza的上市申请于2020年6月获得CDE受理,并被纳入优先审评。2020年11月,该药已被纳入了第三批临床急需境外新药名单。根据优先审评公示信息,Xofluza本次在中国申请的适应症为——用于12周岁及以上的流感患者,包括存在流感并发症高风险的患者。
智通声明:本内容为作者独立观点,不代表智通财经立场。未经允许不得转载,文中内容仅供参考,不作为实际操作建议,交易风险自担。更多最新最全港美股资讯,请点击下载智通财经App
相关阅读
梁中华:海外疫情再起,原因何在?
2021-04-22 06:30
梁中华
中金:美国宽财政和紧货币组合对全球市场意味着什么?
2021-04-05 20:40
中金研究
苏伊士运河全通!官方声明:所有422艘船只均已通过
2021-04-05 09:38
JT²智管有方
资产泡沫进行时:美国楼市的疯狂已超过2006年
2021-04-05 07:34
华尔街见闻



 扫码下载智通APP
扫码下载智通APP