本文来源于“医药魔方”微信公众号。
新冠疫情环绕的2020年落下帷幕。医药魔方对本年度中国创新药license in和license out交易事件进行盘点,供大家参考。
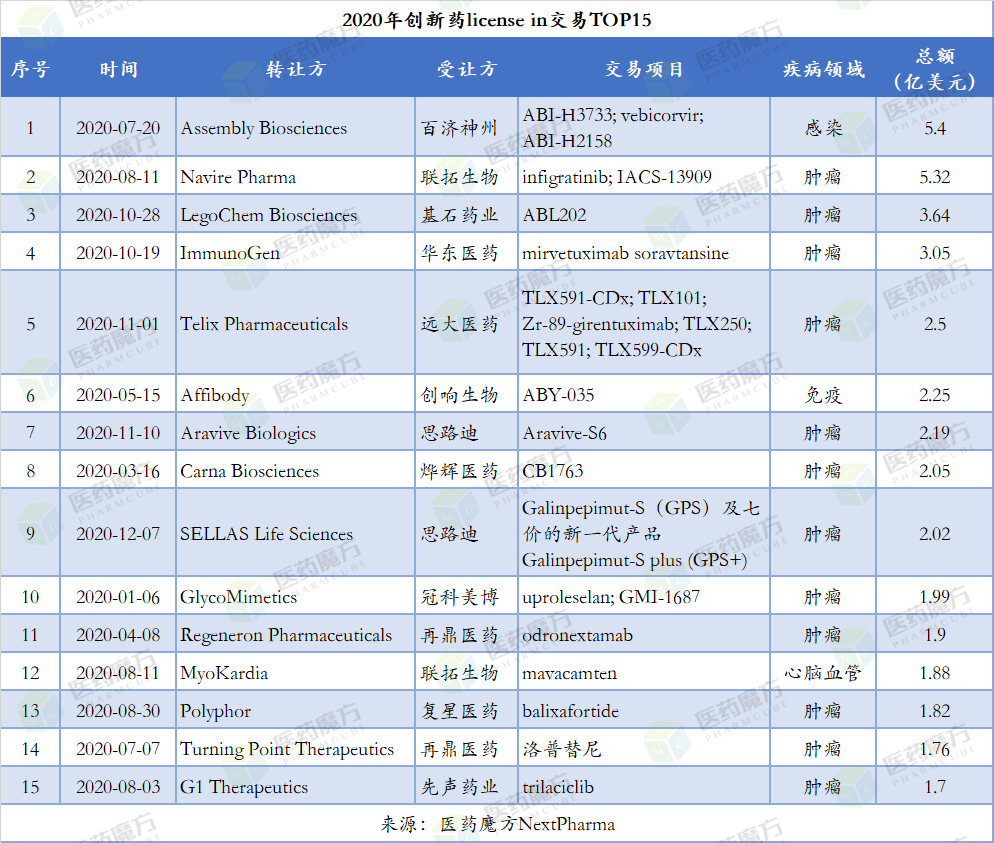
说明:创新药定义参考医药魔方NextPharma数据库2020年7月20日,Assembly授予百济神州ABI-H0731、ABI-H2158及ABI-H3733在大中华区的独家开发和商业化权利。该交易的首付款4000万美元,潜在里程碑付款5亿美元。ABI-H0731以及ABI-H2158目前正处于II期临床试验阶段,ABI-H3733正在进行I期床开发。百济神州将负责在中国的开发、药政注册以及商业化活动。Assembly保留在除上述地区以外的全球范围内对其乙肝研发管线的全部权利。目前乙肝的标准治疗为长期抑制性疗法,该疗法可降低但不能消除病毒,因而治愈率较低。目前对新型乙肝疗法存在极大的需求。通过此次合作,百济的研发管线也由癌症适应症拓展至肝脏疾病。中国有着极大的乙肝治疗需求,三分之一的乙肝患者在中国,期待新疗法的成功,为患者带来新的治疗选择。2020年8月11日,BridgeBio与联拓生物共同签署两款药物infigratinib和BBP-398的研发合作协议,交易首付款2650万美元,潜在里程碑付款5.05亿美元。infigratinib是一款首创的选择性FGFR抑制剂,目前正处于III期开发阶段,用于治疗由FGFR基因异常导致的胆管癌和尿路上皮癌等疾病。作为QED PROOF全球III期研究的一部分,联拓生物正在中国大陆开展infigratinib一线治疗胆管癌的研究,同时计划启动infigratinib治疗胃癌以及其他因FGFR基因变异导致的肿瘤疾病的IIa期研究。BBP-398是一种新型SHP2抑制剂,主要用于治疗耐药性肿瘤和其他难治性肿瘤。在中国大陆和亚洲其他主要市场,联拓生物将在各种实体肿瘤(如非小型细胞癌、结肠直肠癌和胰腺癌)中研究BBP-398与其他药物组合的联合疗法。2020年10月29日,基石药业宣布与LegoChem Biosciences就LCB71的开发和商业化达成一项授权协议。LCB71是一款以受体酪氨酸激酶样孤儿受体1(receptor tyrosine kinase-like orphan receptor 1, ROR1)为靶点的抗体偶联药物,当前处于临床前阶段。ROR1是一种极具潜力的ADC靶点,针对多种实体和血液恶性肿瘤。ROR1在多种癌症中都有高表达,包括各类白血病、非霍奇金淋巴瘤、乳腺癌、肺癌及卵巢癌。LCB71具有专有的肿瘤激活的吡咯并苯二氮卓 (pyrrolobenzodiazepine, PBD)前毒素,可解决与传统PBD载荷有关的典型毒性问题。LCB71已在几种临床前癌症模型中证明具有完全的肿瘤抑制作用,这或将会转化为多种实体和血液恶性肿瘤的广泛治疗指标。此外,LCB71利用定向偶联技术获得精准的药物抗体比率,有效地支持药物血清半衰期并改善其药代动力学特性,也便于实现均质生产及大规模生产。2020年10月20日,华东医药公告,其全资子公司中美华东与美国ImmunoGen, Inc.达成独家临床开发及商业化协议。华东医药获得ImmunoGen在研产品Mirvetuximab Soravtansine(新型抗体偶联药物 ADC,用于治疗卵巢癌)在大中华区的独家临床开发及商业化权益。中美华东将向ImmunoGen支付4000万美元首付款和最高可达2.65亿美元的里程碑付款,以及约定比例的销售额提成费。2020年9月17日, ImmunoGen公布了mirvetuximab soravtansine治疗铂敏感卵巢癌的1b期试验FORWARD II(NCT02606305)最终数据。在既往接受过至多二线疗法的FRα中度/高度表达卵巢癌患者中,mirvetuximab soravtansine + 贝伐珠单抗 + 卡铂的ORR达到83%,mDOR为10.9个月,mPFS为12.8个月。此三联疗法在复发铂敏感卵巢癌治疗中,表现出良好的抗肿瘤活性和耐受性。2020年11月2日,澳大利亚生物技术公司Telix Pharmaceuticals宣布与远大医药建立了商业合作伙伴关系,共同开发Telix的分子靶向放射(MTR)产品组合。远大医药宣布累计支付预付款及里程金最多2.25亿美元,获得多款用于治疗前列腺癌、透明细胞肾细胞癌及胶质母细胞瘤的创新型RDC产品(TLX591、TLX 250、TLX101)及多款用于肿瘤诊断的创新型RDC产品(TLX591-CDx、TLX 250-CDx、TLX599-CDx)在大中华地区的开发、生产及商业化权益。根据Statista数据显示,2018年全球放射性药物市场规模在39.8亿美元左右,预计到2023年将达到50.6亿美元。根据Frost & Sullivan预测,中国放射性药物产业年复合增速在18.6%左右,预计到2021年国内市场总额将达到人民币90亿元。2020年5月15日,创响生物宣布就一款自身免疫创新药物ABY-035和瑞典Affibody公司达成全球战略合作协议。创响生物获得ABY-035在中国大陆、香港、台湾、澳门和韩国等国家和地区的独家开发和商业化权利,以及在日本以外的亚太地区进行临床开发的权利。双方还宣布会在多个全球临床试验上进行合作,以达到在多个国家同时注册的目标。ABY-035是抑制白介素17的新型融合蛋白药物,即将完成全球临床2期。ABY-035利用Affibody独创的、具有全球专利的两大技术平台“Affibody 技术平台”和“Albumod技术平台”开发而成。Affibody是一种新型的蛋白药物平台,与传统抗体药物相比,其产品亲和度更高、分子量更低,有极其广泛的商业应用前景。2020年11月11日,思路迪医药(3DMedicines)宣布与Aravive达成合作。思路迪医药将获得Aravive旗下新药AVB-500在大中华区肿瘤领域临床开发及商业化的独家授权。AVB-500是特异性针对GAS6的高亲和力Fc融合蛋白,也是一种新型GAS6-AXL信号通路抑制剂。AXL及其配体GAS6在许多恶性肿瘤中都有高表达和活化,如急性髓系白血病(AML),肾癌,胰腺癌,乳腺癌,肺癌,卵巢癌以及前列腺癌等。目前,Aravive已成功完成AVB-500在铂耐药性卵巢癌(PROC)适应症的美国Ib期临床试验,并即将进入III期注册临床研究。这是继2020年10月27日从海和药物引进RMX1001和RMX1002两款镇痛新药后,思路迪医药在应对肿瘤慢病化趋势、进一步构建贯穿肿瘤免疫治疗全周期管线布局上的又一重要举措。2020年3月16日,Carna Biosciences宣布与烨辉医药签署在大中华区开发和商业化二代BTK抑制剂AS-1763的授权许可协议,交易总金额2.05亿美元。目前全球有3款BTK可逆抑制剂在美国处于I期临床阶段,中国尚未见申报。针对C481S耐药的BTK抑制剂是热点研发领域,代表性药物包括ARQ531 (ArQule),SNS-062(Sunesis),LOXO-305 。2019年12月9日,制药巨头默沙东宣布以27亿美元收购ArQule,礼来在ASH2019大会上分享了其令人鼓舞的BTK抑制剂临床数据。2020年4月份Sanofi宣布过脑BTK抑制剂在复发性多发性MS的II期试验达到主要终点。2020年12月7日,思路迪医药获得SELLAS旗下肿瘤免疫治疗创新药Galinpepimut-S(GPS)及七价的新一代产品Galinpepimut-S plus (GPS+) 在大中华区所有适应症的独家开发及商业化权利。根据合作协议,SELLAS 将获得750万美元的签约付款,交易总金额2.02亿美元。GPS是一种靶向WT1(Wilms肿瘤蛋白)的创新性肿瘤免疫治疗新药,用于治疗WT1抗原过表达的恶性血液瘤和实体瘤,并有望成为该靶点的全球首创药物。2020年1月,SELLAS 进入CR2型(second complete remission)急性髓细胞白血病(AML)的关键III期临床试验。GPS及GPS+的引进,和此前获取的两款针对肿瘤疼痛的非阿片类镇痛新药RMX1001和RMX1002,及高效阻断GAS6-AXL信号通路的创新药AVB-500,标志着思路迪医药在肿瘤免疫治疗全周期管线布局的道路上又迈出了一步。2020年1月6日,GlycoMimetics 和冠科美博宣布就急性髓系白血病治疗药物Uproleselan和 GMI-1687的中国市场独家开发和商业化权利签署合作许可协议。Uproleselan和 GMI-1687是临床应用前景广泛 的E-选择素拮抗剂,其中Uproleselan在美国已经进入III期临床试验,用于治疗包括急性髓系白血病(AML)在内的血液恶性肿瘤;GMI-1687则是第二代药效更高的产品。Uproleselan能阻断E-选择素(骨髓细胞上的一种粘附分子)与血液癌细胞结合,从而阻断骨髓微环境中白血病细胞的耐药机制。它用于治疗复发或难治性成人AML,在美国处于III期临床阶段,已获得FDA突破性疗法资格。在一项针对新诊断的老年AML患者和复发或难治性AML患者的I/II期临床试验中,与第三方临床试验中的历史数据相比,标准化疗联合Uproleselan治疗的患者获得了比预期更好的缓解率(RR)和总生存期(OS),以及低于预期的诱导相关死亡率。患者对治疗的耐受性良好,不良反应也少于预期。GMI-1687是一款第二代高效E-选择素拮抗剂,正处于临床前研究阶段。它有望用于皮下(SC)给药,临床应用前景广泛。在临床前研究模型中,皮下注射给药时,GMI-1687具有与Uproleselan相当的活性,而且剂量可以比Uproleselan低约250倍。GMI-1687有望拓展门诊患者使用 E-选择素拮抗剂的治疗需求,延长产品的生命周期。2020年4月8日,再生元(Regeneron)与再鼎医药(Zai Lab)宣布宣布了一项战略合作,将在中国大陆、香港、台湾和澳门开发和商业化REGN1979(CD20xCD3双特异性抗体)。这项合作将支持REGN1979针对B细胞非霍奇金淋巴瘤(B-NHL)的2期临床。REGN1979是利用Regeneron双特异性抗体平台开发的新型双特异性单克隆抗体,旨在通过将细胞毒性T细胞(与CD3结合)与淋巴瘤细胞(与CD20结合)连接并激活来杀死肿瘤。根据该协议的条款,Regeneron将获得3000万美元的预付款,并有资格获得高达1.6亿美元的额外监管和销售里程碑。在某些试验中,Zai Lab将负担REGN1979的全球开发费用,并将获得在中国大陆、香港、台湾和澳门开发和独家商业化REGN1979肿瘤学的权利。REGN1979被美国食品和药物管理局(FDA)授予孤儿药指定,用于治疗滤泡性淋巴瘤(FL)和弥漫性大B细胞淋巴瘤(DLBCL)。REGN1979目前正在进行一项1期试验以及潜在的2期试验用于治疗FL、DLBCL和其他淋巴瘤晚期。2020年8月11日,联拓生物与MyoKardia公司达成战略合作,以在中国及其他亚洲地区开发和商业化后者的创新心肌病靶向疗法mavacamten。Mavacamten能够降低心脏肌球蛋白重链的ATP酶活性,从而降低心肌收缩力,这是第一个针对肥厚型心肌病分子缺陷开发的药物,曾获FDA授予的突破性疗法认定。Mavacamten是MyoKardia公司的主要治疗候选药物,计划于2021年第一季度在美国提交候选药的新药申请,并同时开发它对于治疗非梗阻性肥厚型心肌病患者及射血分数保留性心脏衰竭患者的研究。2020年8月31日,复星医药与Polyphor宣布签订 CXCR4拮抗剂Balixafortide独家许可协议。复星医药将在中国开展临床及商业化针对治疗转移性乳腺癌及其他潜在癌症的CXCR4拮抗剂Balixafortide;复星医药将向Polyphor支付1,500万美元首付款,临床开发里程碑款项合计不超过1,900万美元,销售里程碑款项不超过14,800万美元,以及约定比例的销售提成。Balixafortide是Polyphor研发的一款强效、高选择性CXCR4拮抗剂。CXCR4对肿瘤的生长、侵袭、血管生成、转移和对治疗药物的耐药性中起着重要作用,CXCR4过度表达与许多癌症亚型的不良预后相关。2020年7月7日,再鼎医药与Turning Point Therapeutics宣布达成独家授权协议,以推进Turning Point的主要候选药物Repotrectinib在大中华区(中国内地、香港、澳门和台湾)的开发及商业化。Turning Point Therapeutics将获得2500万美元的现金预付款,并有资格获得最高至1.51亿美元的潜在开发、注册和基于销售的里程碑付款。此外,再鼎医药将根据Repotrectinib在大中华区的年度净销售额向Turning Point支付特许权使用费。Ropotrectinib是下一代ALK/ROS1/TRK抑制剂,可以完全进入ATP口袋内部,避免各种突变包括溶剂前沿突变带来的空间位阻。Repotrectinib抑制TRK野生型和溶剂前沿突变的活性是LOXO-195的10倍以上,抑制TRKAF589L、TRKC F617I看门突变的活性是LOXO-195的100倍以上。2020年12月8日, Turning Point宣布FDA授予洛普替尼突破性疗法资格,用于一线治疗ROS1+NSCLC。此资格授予基于1/2期试验TRIDENT-1(NCT03093116)结果,第一阶段(n=11)ORR达到91%,第二阶段(n=7)ORR达到86%。洛普替尼是新一代靶向ROS1和TRK的激酶抑制剂,可以克服TKI耐药突变,此前FDA授予其治疗ROS1+NSCLC以及NTRK+晚期实体瘤的快速通道资格。2020年8月3日,先声药业(Simcere)与美国肿瘤学公司G1 Therapeutics宣布签署一项独家许可,引进trilaciclib在大中华地区(中国大陆,香港,澳门,台湾)所有适应症的开发和商业化的权益。Trilaciclib是一种短效CDK4/6抑制剂,暂时地将造血干细胞/祖细胞截在G1期,在化疗结束后重新进入细胞周期,长时间抑制CDK4/6则会阻断T细胞增殖并造成骨髓抑制。2020月8月17日, G1宣布FDA受理trilaciclib的NDA,并授予优先审评资格,用于正在接受化疗小细胞肺癌患者降低化疗毒性损伤。PDUFA日期为2021年2月15日。此申请基于三项试验结果,小细胞肺癌患者在化疗之前接受静脉输注trilaciclib,显著提升骨髓保留获益。此前FDA授予trilaciclib治疗SCLC突破性疗法资格。
(编辑:文文)


















 扫码下载智通APP
扫码下载智通APP