亚盛医药-B(06855)从生产端打通奥瑞巴替尼商业化通路,子公司获广东首个原创化药1类新药MAH《药品生产许可证》
一家生物医药企业若想立足行业之林,不仅需要深厚的研发底蕴和优势的创新产品,商业化能力同样是不可或缺的重要一环。
今年6月,亚盛医药宣布提交奥瑞巴替尼(HQP1351)的新药上市申请,预示着该药正式进入上市倒计时,与此同时相关商业化进程也紧锣密鼓地开始进行。现在,公司已在生产端建立了可靠的质量管理体系,打通了奥瑞巴替尼顺利商业化的通路
10月29日,亚盛医药-B(06855)宣布,其全资子公司广州顺健生物已获得由广东省药品监督管理局颁发的药品上市许可人(MAH)《药品生产许可证》(B证)。
值得一提的是,此次亚盛医药获得的奥瑞巴替尼片(HQP1351的拟定中文通用名)《药品生产许可证》是广东省颁发的第一个原创化药1类新药的MAH《药品生产许可证》。
智通财经APP了解到,MAH制度的落地实施是推动生物医药产业发展重要的一环,药品上市许可和生产许可分离的管理模式有利于药品研发和创新,有助于研发者获得和集中资金、技术和人力进行持续研究和新药研发;同时也有助于优化医药产业资源配置,并可对药品全生命周期进行强化监管。
根据新修订的《药品管理法》和《药品生产监督管理办法》,药品上市许可持有人作为从事药品生产的主体,无论自行生产还是委托生产,都需取得《药品生产许可证》。作为国内领先的原创新药研发企业,亚盛医药积极响应政策要求,成为广东省首家获得原创化药1类新药MAH《药品生产许可证》的企业。
此次亚盛医药获得《药品生产许可证》引发了市场的广泛关注,因为这意味着奥瑞巴替尼的商业化进程又快了一步。
实际上,资本市场对于奥瑞巴替尼的落地上市一直都有较高的期待。作为治疗伴有T315I突变的慢性髓性白血病(CML)的特效药,奥瑞巴替尼的未来市场潜力也预计将在其上市后转化为公司估值的真金白银。
据智通财经APP了解,从市场空间来看,奥瑞巴替尼面对的全球CML市场规模在2030年将增至58亿美元,而在中国的CML药物市场到2023年市场规模将预计增长至142亿元;
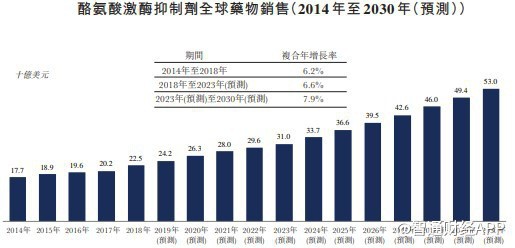
从市场竞争角度来看,目前与HQP1351存在潜在竞争关系的药物——全球首款三代TKI帕纳替尼,目前并未在中国上市。也就是说,HQP1351若成功在国内获批上市,将成为国内首款上市的第三代BCR-ABL抑制剂,市场独占性优势明显。
而取得《药品生产许可证》意味着亚盛医药的质量管理体系的建立和对于未来上市药物生产的监督和管理的良好开端,为公司核心品种奥瑞巴替尼的上市申请与商业化生产打下坚实的基础。
对此,亚盛医药董事长、CEO杨大俊表示:“我们很高兴成为广东省首家获得原创化药1类新药MAH《药品生产许可证》的企业,感谢政府相关监督管理部门的及时审核和认可。MAH制度的实施对于新药研发企业有重要意义。作为上市许可持有人,我们将更好的践行自己的责任,对药品从研发到使用以及上市后的药品安全性、有效性和质量可控性负责。获得《药品生产许可证》是亚盛医药的又一重大里程碑,是公司商业化布局的关键一环。未来我们将继续努力,希望早日将奥瑞巴替尼推向上市,造福更多患者。”



 扫码下载智通APP
扫码下载智通APP