嘉和生物-B(06998):短线有爆款,长线有实力
高瓴入驻,获市场一致看好的嘉和生物-B(06998),上市首日表现也可圈可点,盘中涨幅一度超过30%。
从2018年4月30日港交所推出“上市新规”以来,短短两年时间里,港股资本市场已成为全球第二大生物科技企业上市中心。此前上市的信达生物、启明医疗等等股价早已脱离发行价区域,嘉和生物的上市意味着,未盈利生物科技板块中再添一员猛将。
嘉和生物专注于肿瘤及自身免疫药物的研发及商业化,产品管线及项目开发管理团队都颇具实力,而且有多款产品已经处于临床开发后期接近实现商业化。智通财经APP观察到,在未盈利生物科技公司中,研发管线丰富、产品实现或接近商业化的医药公司受到资金的青睐。
或许正是因为具备这样的特质,才获得包括高瓴资本在内的投资机构看好,就在今年6月份嘉和生物申请上市前夕完成的1.6亿美元B轮融资中,原有股东高瓴资本继续领投,新进入的投资者包括淡马锡、华润正大生命科学基金、海通开元国际和Cavenham PE等知名机构。
15条产品线,极具竞争力
嘉和生物成立于2007年,公司专注于主要治疗领域,以解决在肿瘤、自身免疫以及其他慢性病方面大量未得到满足的医疗需求。公司在中国设立了三大办事处及产业基地——上海张江、云南玉溪和北京办公室,并在美国南旧金山拥有双特异性抗体实验室。嘉和生物目前拥有近400名员工,其中80%为科研人员。
基于一支有实力的科研团队和长时间的研发积累沉淀,嘉和生物目前拥有一个颇具竞争力的研发管线。招股书显示,嘉和生物依靠内部自主研发建立了由15款候选抗体药物组成的丰富产品管线,涉及CDK4/6、HER2、PD-1、TNF-α、VEGF等全球TOP10畅销药相关的热门靶点,在中国具有极大的商业化潜力。
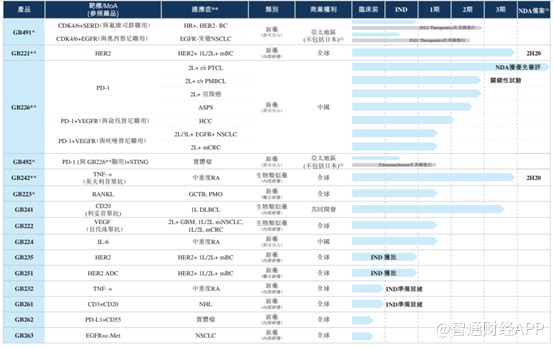
智通财经APP观察到,目前公司有17项临床试验正在亚洲进行,预计未来12至18个月内将分别向国家药监局提交两项新药上市申请(NDA),向国家药监局及美国食药监局提交四项临床研究用新药申请(IND)。
目前,嘉和生物有6款候选药物在国内市场具有较大的商业潜力,涵盖已知及新型生物学通路,具体包括:1)GB491(lerociclib) , 有望成为中国治疗HR+/HER2-乳腺癌的同类产品中最佳的口服CDK4/6抑制剂;2) GB226(geptanolimab),一款新型PD-1单抗候选药物;3)GB221,一款曲妥珠单抗生物类似药,有望成为前三款面世的用于治疗HER2+转移性乳腺癌(mBC)的国内新型单抗;4) GB242,一款英夫利昔单抗生物类似药;5) GB223,一款前景广阔的核因子kappaB配体的受体启动剂(RANKL)单抗候选药物;6)GB492,一款干扰素基因蛋白(STING)激动剂,预期与GB226结合使用对治疗实体瘤具积极协同效应,亦是国内一款首创新药。
以GB491(lerociclib)为例,其相比当前已上市的CDK4/6抑制剂展示出了更好的安全性和耐受性,特别是在降低中性粒细胞减少症方面具有优势。目前新辅助和转移性的亚洲HR+/HER2-乳腺癌患者,尤其是中度及高危患者,需要的治疗持续时间长,因此对耐受性的要求更高,GB491的良好安全性可以改善患者体验,降低随访和抽血次数,减轻病院负担,满足了患者及医院两方面的医疗需求。
CDK4/6抑制剂革新了占乳腺癌75%左右的HR+/HER2-亚型人群的治疗方案,礼来abemaciclib近期更是首次在临床试验中证实可降低高风险HR+/HER2-早期乳腺癌患者的复发风险,进一步提升CDK4/6抑制剂在乳腺癌中的临床治疗地位,GB491也由此展现出了巨大的市场潜力。
一体化制药平台,商业化潜力巨大
除了具备丰富的研发管线外,嘉和生物还打造出了一个具备较强技术壁垒的全面一体化的生物制药平台。
嘉和生物的一体化生物制药平台涵盖探索、研究、临床开发、CMC(化学、制造及控制)以及业务拓展等所有关键药物开发功能,可以通过在开发过程早期发现并解决潜在的CMC及临床门槛管理药物开发的风险,从而专注于最有潜力产生临床效果及商业可行药物的分子研究。
智通财经APP观察到,在发现及研究阶段,嘉和生物的研发程序始于策略靶标识别及筛选,专注于具有可靠或高临床受益潜力的靶标,一经识别将全力利用上海及旧金山的研究中心,推进协同搜索及研究工作。在临床开发阶段,相关团队成员各自在中国的职业生涯中对于60多项IND申请及22项NDA的提交,以及16款产品的成功获批及发布起重要作用。业务发展阶段,公司开发出一套主动而系统化方法来评估资产已获得许可机会,尤其是专注既可补充现有药物管线并彼此具有协同效应的候选药物。在化学、生产及控制阶段,公司在上海拥有强大的CMC能力,为公司及合作伙伴就20多款抗体向国家药监局提交的IND申请及/或计划向美国食药监局提交的IND申请提供了支持。
嘉和生物在云南玉溪拥有可商业化的制造能力,质量卓越及成本效益更高,拥有浓缩补料分批培养基灌流培养技术,与传统技术相比,可产生更高的滴定率及产率,推动行业范围上限。根据灼识咨询报告,浓缩分批补料及灌装技术的产出率是分批补料技术的5到10倍,相同产出下,可节省40%以上的固定成本。
除却平均具备15年行业经验的核心管理团队成员之外,目前公司正在组建内部商业化团队,用来支持前两至三款获批的药物资产(包括GB226)的上市,预计于2021年下半年推出该等药物资产。短期内,公司计划招聘管理人才,致力于PD-1及乳腺癌药品的商业化,计划于2021年前将内部商业化团队拓展至150至300人,涵盖主要城市的一线医院,同时向低线城市渗透。另外还将与国际生物制药公司建立战略或作关系,扩大全球布局。
综上,从当前产品管线来看,嘉和生物在短期内有六款市场前景广阔的候选药物,其中包括3款产品即将商业化。灼识咨询研究报告显示,嘉和生物开发的三大肿瘤靶标相关药物的中国市场规模到2030年预计将逾千亿元人民币。此外,灼识咨询还指,估计到2030年GB491(mBC疗法)和GB492(STING激动剂)在中国市场规模将分別达到105亿元和40亿元。
长期看,嘉和生物拥有高度一体化的生物制药技术平台,且长期专注于肿瘤和自身免疫疾病领域,拥有持续发现新项目的自我造血能力,发展后劲同样值得看好。从各大投资机构纷至沓来可见一斑。



 扫码下载智通APP
扫码下载智通APP