盘点2020上半年中国创新药上市申请,最大亮点是它们!
本文来自医药观澜。
2020年上半年已经结束。根据中国国家药监局药品审评中心(CDE)官网信息,上半年有100多个(按受理号统计,不含已获批的药物)创新药上市申请(NDA)获受理。这些申报上市的创新药可谓亮点颇多。
化药领域,至少有四家中国创新药企业首次提交NDA,另有多款引人注目的进口药首次在中国申报上市。生物药领域也迎来申报高潮,来自不同公司的7款PD-1/L1抗体提交上市申请。此外,还有CAR-T疗法、双特异性抗体、抗体偶联药物等热门药物。
本文节选部分与大家分享。(本文仅统计上半年提交尚未获批的创新药,不含上半年提交已获批的新药)
亮点一:四家中国创新药企业首次提交NDA
截止6月29日,上半年至少有11款中国国产1类化学创新药提交上市申请,其中有8款为首次申报上市,3款为新适应症上市申请。从适应症来看,这些药物大部分用于治疗癌症,包括肝细胞癌、非小细胞肺癌、卵巢癌等等。值得一提的是,至少有四家中国创新药企业首次提交了NDA,包括亚盛医药-B(06855)、基石药业-B(02616)、泽璟制药、盟科医药。
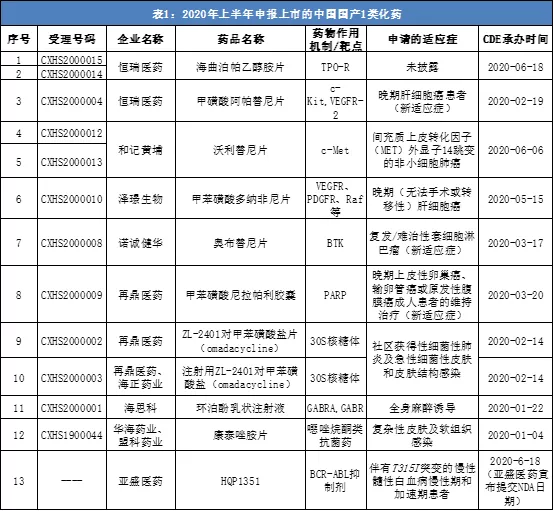
数据来源:CDE、公开信息。统计周期:2020/1/1-2020/6/29,药明康德内容团队制图。本表根据公开信息整理,如有遗漏欢迎指出。
这四家企业提交上市申请的四款产品中,有三款为抗癌药,一款为抗菌药,如果申请顺利获批,这几家公司将迎来首款获批上市的产品:
6月18日,亚盛医药宣布提交HQP1351的新药上市申请,用于治疗伴有T315I突变的慢性髓性白血病(CML)慢性期和加速期患者。这是亚盛医药创立以来的第一个新药上市申请,也将有望成为中国国内首个上市的第三代BCR-ABL抑制剂。
今年4月,基石药业提交了avapritinib用于胃肠道间质瘤(GIST)晚期成人患者的两个适应症上市申请,这是基石药业首个获NMPA受理的新药上市申请。Avapritinib是一款强效、高选择性的、在研口服针对KIT和PDGFRA基因突变的抑制剂,由基石药业合作伙伴Blueprint Medicines开发。
多纳非尼是泽璟制药开发的口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,既可抑制VEGFR、PDGFR等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶,并抑制下游的Raf/MEK/ERK信号传导通路,抑制肿瘤细胞增殖和肿瘤血管的形成。该药申报上市的适应症为晚期(无法手术或转移性)肝细胞癌。
康泰唑胺是盟科医药自主研发的一个具有全新药物结构的新型噁唑烷酮类抗菌药物,也是该公司成立13年以来开发的首款抗菌新药。该公司旨在开发康泰唑胺用于治疗耐药菌例如耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素肠球菌(VRE)引起的感染。康泰唑胺本次提交上市申请的适应症为复杂性皮肤及软组织感染。
还值得一提的是,诺诚健华的BTK抑制剂奥布替尼今年3月提交了第二个NDA,适应症为复发/难治性套细胞淋巴瘤(MCL)患者。该药是诺诚健华旗下研究进展最快的产品。去年11月,诺诚健华提交了奥布替尼治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的首个NDA。
亮点二:17款生物创新药申报上市,PD-1/L1占7款
截止6月29日,至少有17款生物类创新药在上半年申报上市。从药物作用机制来看,单抗类药物最多,有10款。其它几款药物也基本涵盖了目前的热门研究靶点,包括靶向CD19的CAR-T疗法、双特异性抗体、抗体偶联药物(ADC)、TPO-R受体激动剂等等。
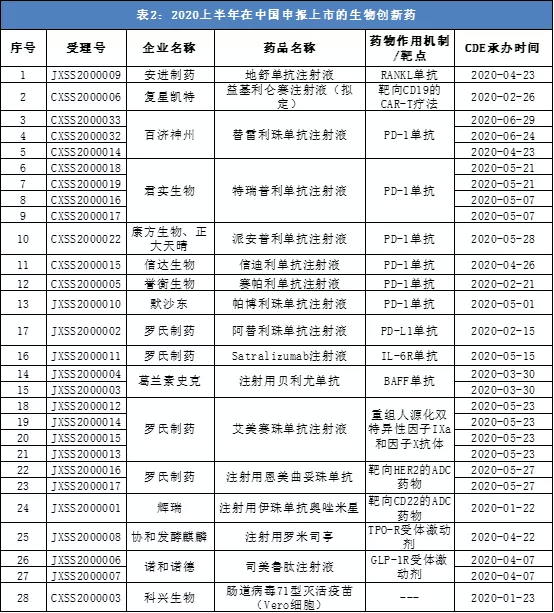
数据来源:CDE、公开信息,统计周期:2020/1/1-2020/6/29,药明康德内容团队制图。本表根据公开信息整理,如有遗漏欢迎指出。
值得一提的是,在申报上市的单抗类药物中,PD-1/L1抗体占到了7款,其中有5款是新适应症申请,分别来自百济神州(06160)、君实生物-B(01877)、信达生物(01801)、默沙东(MRK.US)和罗氏(Roche)。
其中,百济神州在第二季度接连提交了三个替雷利珠单抗的上市申请,分别针对晚期鳞状非小细胞肺癌、晚期非鳞状非小细胞肺癌、肝细胞癌。君实生物提交了特瑞普利单抗治疗尿路上皮癌和鼻咽癌两个新适应症申请。信达生物提交了信迪利单抗的第2个NDA,针对非鳞状非小细胞肺癌。默沙东和罗氏分别提交了帕博利珠单抗(第6个NDA)、阿替利珠单抗(第2个NDA)的新适应症申请。
此外,辉瑞(Pfizer)开发的靶向CD22的ADC药物Besponsa(注射用伊珠单抗奥唑米星)也于今年1月在中国首次提交了上市申请。
亮点三:罗氏、渤健、辉瑞等公司多款新药首次申报上市
上半年在中国提交上市申请的进口化学药中, 有多款为首次申请,来自拜耳(Bayer)、罗氏、武田(Takada)等多家公司。这些药物涵盖了很多热门靶点,包括雄激素受体(AR)、Bcl-2、FLT3等等。
值得一提的是,在这些药物中,有多款引人注目的“首个”创新药:罗氏公司的“first-in-class”创新药玛巴洛沙韦片(英文商品名:Xofluza),是近20年来美国FDA批准的第一款具有新型作用机制的抗流感病毒单剂量口服药物;基石药业和Blueprint Medicines联合提交的阿泊替尼片(avapritinib)是目前首个且唯一一个在美国上市的胃肠道间质瘤精准靶向药物;艾伯维(AbbVie)提交的维奈克拉片(venetoclax)是首个获得美国FDA批准上市的Bcl-2抑制剂,曾多次被美国FDA授予突破性疗法认定。
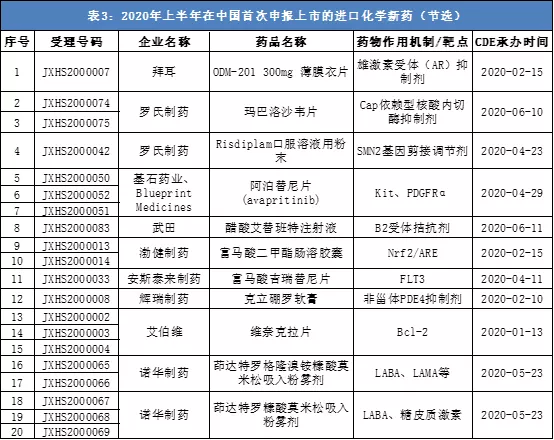
注:本表为不完全统计。数据来源:CDE、公开信息,统计周期:2020/1/1-2020/6/29,药明康德内容团队制图。本表根据公开信息整理,如有遗漏欢迎指出。
此外,还有多款年销售额超过10亿美元的重磅创新药也提交了上市申请。例如,渤健(Biogen)公司的富马酸二甲酯肠溶胶囊(英文商品名:Tecfidera)为多发性硬化症重磅药物,2019年全球销售额高达44.33亿美元。辉瑞(PFE.US)的JAK抑制剂枸橼酸托法替布缓释片(英文商品名:Xeljanz)是该公司自身免疫疾病治疗领域的核心产品之一,2019年销售额达22.42亿美元。阿斯利康(AZN.US)的SGLT-2抑制剂达格列净片(英文商品名:Farxiga)2019年销售额也超过了15亿美元。
亮点四:生物类似药迎上市申报高潮
近两年来,中国国产生物类似药研究取得了巨大的进展和突破。继2019年迎来4款生物类似药获批后,一波由中国公司研制的生物类似药已经突破临床试验大关,并向中国国家药监局(NMPA)递交了上市申请。
截止6月29日,2020上半年至少有7款生物类似药申报上市,其中有4款为贝伐珠单抗、2款为英夫利西单抗、1款为阿达木单抗。
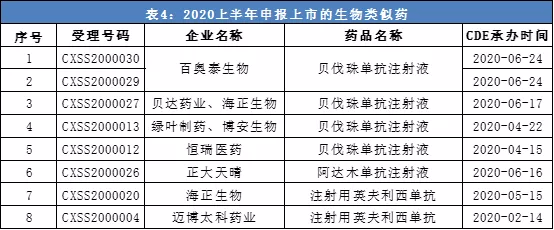
数据来源:CDE、公开信息,统计周期:2020/1/1-2020/6/29。本表根据公开信息整理,如有遗漏欢迎指出。
贝伐珠单抗是一种血管内皮生长因子(VEGF)抑制剂,原研产品为罗氏旗下安维汀,已在全球范围内获批治疗结直肠癌、乳腺癌、肾癌、宫颈癌、卵巢癌、非鳞状非小细胞肺癌等多个癌症,是全球十大畅销药物之一。中国目前有两款贝伐珠单抗生物类似药获批,来自齐鲁制药和信达生物。
英夫利西单抗原研药品由强生(Johnson & Johnson)公司开发,是全球首个抗肿瘤坏死因子(TNF-a)单克隆抗体,也是首个获批适用于胃肠病、风湿病和皮肤病三个不同领域的TNF-a抑制剂。中国境内现仅有原研药品类克获批。根据CDE官网信息,目前仅有海正生物和迈博太科药业两家公司的英夫利西单抗生物类似药申报上市。(编辑:孟哲)



 扫码下载智通APP
扫码下载智通APP