3月在美国刚获批,赛诺菲(SNY.US)CD38抗体昨在中国提交两项临床试验申请
作者:
智通财经 孟哲
2020-05-11 13:59:51
根据中国国家药监局药品审评中心(CDE)网站最新公示,赛诺菲(SNY.US)旗下的isatuximab注射液在中国提交了两项新的临床试验申请。
智通财经APP获悉,根据中国国家药监局药品审评中心(CDE)网站最新公示,5月10日,赛诺菲(SNY.US)旗下的isatuximab注射液在中国提交了两项新的临床试验申请。
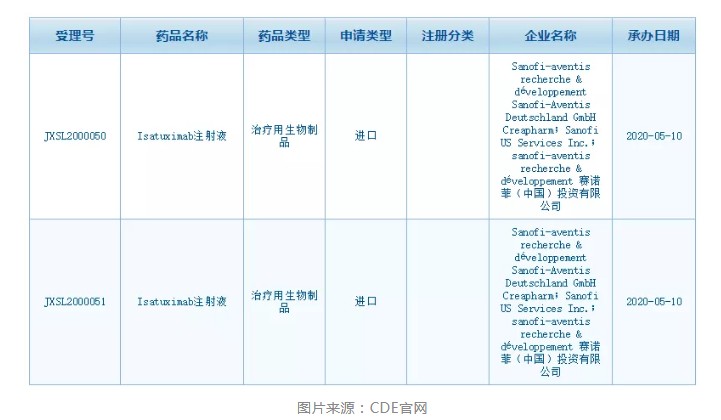
在中国,赛诺菲最早于2017年提交了一项isatuximab注射液的临床试验申请,本次是该药第二次在中国提交临床试验。根据中国药物临床试验登记与信息公示平台,赛诺菲正在多发性骨髓瘤患者中开展两项临床试验。
据了解,Isatuximab是一款CD38抗体,该药在今年3月刚获美国FDA批准上市,联合其它药物治疗成年多发性骨髓瘤(MM)患者。这也是继强生的达雷妥尤单抗后,全球范围内第2款获得美国FDA批准上市的CD38抗体药物。
Isatuximab在美国的获批是基于一项包含307名复发、难治性多发性骨髓瘤患者的临床试验,这些患者接受过至少两次前期疗法的治疗。试验结果表明,与泊马度胺和低剂量地塞米松构成的活性对照组相比,isatuximab与泊马度胺和低剂量地塞米松联合显著提高了患者的治疗效果。
智通声明:本内容为作者独立观点,不代表智通财经立场。未经允许不得转载,文中内容仅供参考,不作为实际操作建议,交易风险自担。更多最新最全港美股资讯,请点击下载智通财经App
相关阅读
赛诺菲(SNY.US)招募数千人参加疫苗试验,预计9月份进入早期阶段
2020-05-06 11:08
林喵
抗COVID-19药物研发动向:Moderna(MRNA.US)递交II期IND申请,再生元(REGN.US)和赛诺菲(SNY.US)联合公布2阶段初步结果
2020-04-28 09:12
程翼兴
赛诺菲(SNY.US)Q1财报:明星药物Dupixent销售收入增长130%,中国市场收入下滑14%加速转型
2020-04-25 11:17
医药魔方
赛诺菲(SNY.US)和葛兰素史克(GSK.US)签署合作开发疫苗意向书,预计下半年开始临床试验
2020-04-14 19:47
林喵
赛诺菲(SNY.US)口服选择性雌激素受体降解剂在中国申报临床
2020-02-26 19:03
医药魔方



 扫码下载智通APP
扫码下载智通APP