吉利德(GILD.US):多项瑞德西韦III期临床试验结果公布!
本文来自微信公众号“药渡”,作者 向东。
4月29日,吉利德(GILD.US)官网终于公布了万众瞩目的瑞德西韦III期(open-label)临床试验数据,这一数据主要基于吉利德自己开展的主要针对重症COVID-19患者III期SIMPLE临床试验,吉利德并未明确表态该研究数据成功或是失败。对于该临床试验,可浏览文章《“人民的希望”瑞德西韦临床试验前瞻》。
但其官网第二条消息“Gilead Sciences Statement onPositive Data Emerging From National Institute of Allergy and InfectiousDiseases’ Study of Investigational Antiviral Remdesivir for COVID-19”却透露由美国NIAID(国立过敏和传染病研究所)开展的另一项瑞德西韦COVID-19临床试验(该研究为随机双盲安慰剂对照的临床试验)取得了“PositiveData”。

图1. 吉利德披露信息
上述新闻透露NIAID开展的该研究已经达到了主要研究终点,其将在即将举行的简报中披露详细数据。随后,NIAID在其官网公布了部分其开展的涉及1063名患者的随机对照试验数据。根据其公布的数据,接受了瑞德西韦治疗的患者,其康复时间比接受安慰剂的患者快31%(p < 0.001)。其中,接受瑞德西韦治疗的患者的中位恢复时间为11天,而接受安慰剂的患者为15天。结果还显示瑞德西韦能够提高患者存活率,瑞德西韦治疗组的死亡率为8.0%,而安慰剂组的死亡率为11.6%(p = 0.059)。
此外,《柳叶刀》也在29日发表了在中国开展的瑞德西韦临床试验的相关数据,然而该数据表明使用瑞德西韦与改善临床疗效的时间无关(hazard ratio 1.23 [95% CI 0.87–1.75])。
SIMPLE临床试验初步结果
该试验评估了对重症COVID-19住院患者给与瑞德西韦5天或10天的安全性和有效性。研究结果表明,接受5天瑞德西韦治疗的患者与接受10天瑞德西韦治疗的患者在临床状况的改善上较为相似(Odds Ratio: 0.75 [95% CI 0.51 – 1.12] on Day 14)。在两个治疗组中均未发现新的安全性信号。
在本研究中,在5天治疗组中50%患者的临床改善时间为10天,而在10天治疗组中50%患者的临床改善时间为11天。两个治疗组中均有超过一半的患者在第14天出院((5-day: 60.0%, n=120/200 vs.10-day: 52.3% n=103/197; p=0.14)。在第14天,5天治疗组64.5%(n=129/200)的患者和10天治疗组中53.8%(n=106/197)的患者达到临床痊愈。
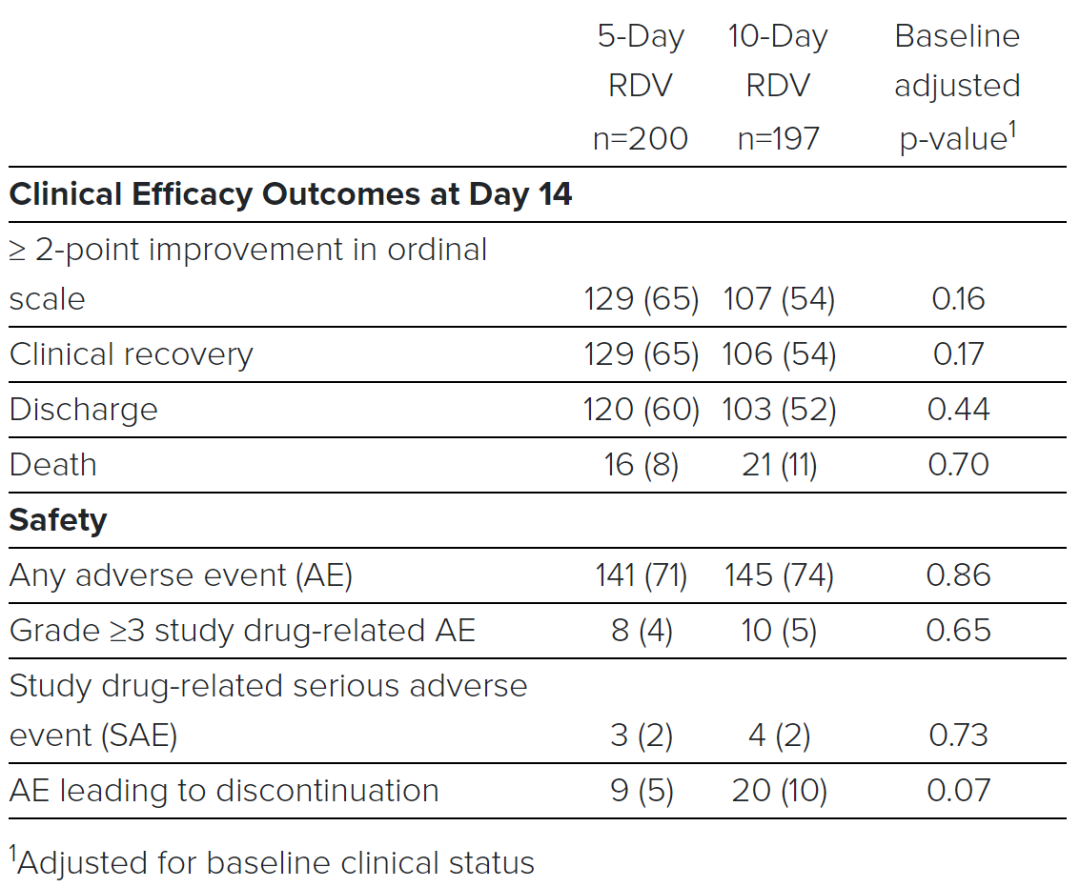
图2. 瑞德西韦临床疗效与安全性数据
同时,该研究表明瑞德西韦在5天和10天治疗组中通常耐受良好。两组中超过10%的患者发生的最常见不良事件(AE)为恶心(5-day: 10.0%, n=20/200 vs. 10-day: 8.6%, n=17/197)和急性呼吸衰竭(5-day: 6.0%, n=12/200 vs. 10-day: 10.7%, n= 21/197)。7.3%(n=28/385)的患者出现3级或3级以上肝酶(ALT)升高,其中3.0%(n=12/397)的患者因肝功能检查升高而停止瑞德西韦治疗。
针对以上研究,吉利德官方仅仅是客观描述了该研究取得的数据,并没有进一步分析其临床成功与否,美国NIAID(过敏和传染病研究所)公布的数据表明其开展的另一项瑞德西韦COVID-19临床试验(该研究为随机双盲安慰剂对照的临床试验)取得了“Positive Data”。这表明瑞德西韦针对COVID-19的临床试验很有可能获得成功,接下来其将面对能否尽快获FDA批准与供应量是否充足的问题。
瑞德西韦能否尽快获批?
基于以上多项研究的数据,就目前美国国内以及除中国外全球严峻的公共卫生形势来看,FDA针对瑞德西韦COVID-19适应症的批准使用有两种可能。
1、直接走正式批准的流程,批准瑞德西韦以COVID-19适应症上市。但这一可能有两个问题,一是即使以最快的速度审评,按照繁琐的药物审批流程也需花不少时间才能最终完成审批;二是该研究毕竟不是双盲对照试验,对其数据的有效性还是存在疑问,在中国开展的双盲对照试验已经终止或暂停,而由NIAID开展的随机双盲安慰剂对照的多中心临床试验(NCT04280705)预计在五月下旬才能公布结果。因此,正式获批可能要等到NIAID的双盲临床试验公布后。
2、直接给与瑞德西韦紧急使用授权(Emergency Use Authorization,EUA),在同时继续推进瑞德西韦在美国及全球的临床试验。这一流程可以使广大患者不必再通过同情用药流程或扩大可及方案,也可以最快的速度用上瑞德西韦。EUA指美国FDA在实际的或潜在的紧急状态下对未获批准的医药产品及已获批准医药产品的未获批准用途的授权。在2009年H1N1流感期间,FDA就授予了当时尚未获批的静脉注射用帕拉米韦EUA用于临床防治严重流感;不久前,FDA又批准磷酸氯喹与硫酸羟氯喹作为EUA使用,用于治疗COVID-19患者。
相对来说,在公共卫生事件形势如此严峻的情况下,瑞德西韦作为EUA使用的可能性更高一点。关于这一点媒体也报道说,FDA计划最早在星期三宣布对瑞德西韦的紧急使用授权。
瑞德西韦供应能否满足需求?
截止4月29日,全球范围确诊患者超308万例,美国已确诊患者101万例。按照吉利德4月5日披露的数据,包括可供分发的成品以及处于最后生产阶段的在研药物在内,其现有的供应量共计为150万剂。根据其在临床试验中正在研究的最佳治疗时间来计算,这一供应量可以满足超过14万个疗程的患者治疗。
考虑到在公共卫生事件的影响下,很多中间体生产厂家受公共卫生事件影响停产停工;且由于瑞德西韦为注射剂,针对其原料药的质量标准相对口服制剂原料药来说要严格的多,短期之内符合质量标准的原料药的供应并不容易;再加上其成品生产要求生产厂房拥有无菌生产能力,所以瑞德西韦的产能是否足够是大家一致关心的问题。

图3. 瑞德西韦生产线
在2月份瑞德西韦临床试验开展后,国内企业博瑞医药、海南海药相继宣布已批量生产瑞德西韦原料药,海南海药更是宣布已完成瑞德西韦制剂的第一批生产,并已具备年产350万支的规模化生产能力。在此之后,“瑞德西韦概念股”如博瑞医药(股票代码:688166)、海南海药(股票代码:000566)、博腾股份(股票代码:300363)、永太科技(股票代码:002362)、九州药业(股票代码:603456)等一路上涨。直到3月初,博瑞医药与海南海药收到监管机构批评,这一势头才有所回落。
但是,根据相关企业之前的公告,像博瑞医药与海南海药等均已实现瑞德西韦原料药的批量制备、博腾股份更是早就为吉利德提供过瑞德西韦中间体生产的服务、永太科技也拿到了吉利德中间体订单,在国内公共卫生事件已基本结束、工厂开工已久的情况下,这些企业拥有足够的产能。在目前全球公共卫生事件如此严峻的态势下,吉利德很可能与不止一家企业达成合作,让其提供中间体、原料药甚至注射剂成品。
根据吉利德官方之前公布的消息,吉利德将力争到10月份生产超过可供50万个疗程使用的药品,到今年年底的可供应量要超过100万个疗程。但是,一旦吉利德自身产能在短期内无法满足全球COVID-19患者的需求,在各国政府专利强制许可的压力下,按照吉利德公司的风格很有可能主动授权相关国家制药企业瑞德西韦生产许可;同样的,公共卫生事件已基本控制的中国将是这些企业药物中间体、原料药的保障。
因此,预计瑞德西韦的供应在初期可能存在紧张的情况,但等到相关合作方的产能充分开动起来,再加上其他药物治疗、患者自愈等情况,瑞德西韦应该很快可以满足剩余患者的需求。
吉利德此次公布的数据以及NIAID公布的瑞德西韦COVID-19临床试验取得“Positive Data”的信息,对于如今全球险峻的公共卫生形势来说不吝于一剂强心针,笼罩在SARS-Cov-2病毒阴影下的患者不再只将命运依托自身身体素质,而是可以以瑞德西韦直接对抗。相信在瑞德西韦的治疗下,加上医务人员的努力,全球范围内公共卫生事件将很快得到有效的控制,低迷的经济也将缓慢回升。
(编辑:马火敏)



 扫码下载智通APP
扫码下载智通APP