罗氏(RHHBY.US)治疗脊髓性肌萎缩症新药Risdiplam在中国申报上市
作者:
智通财经 孟哲
2020-04-26 08:35:34
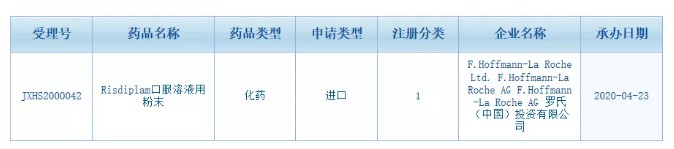
4月23日,国家药品监督管理局正式受理罗氏制药(RHHBY.US)治疗脊髓性肌萎缩症(SMA)药物risdiplam的上市许可申请。
智通财经APP获悉,4月23日,国家药品监督管理局正式受理罗氏(RHHBY.US)治疗脊髓性肌萎缩症(SMA)药物risdiplam的上市许可申请。
脊髓性肌萎缩症(SMA)是一种严重的进行性神经肌肉遗传疾病,患者会出现严重的肌萎缩和其他相关并发症。Risdiplam是全球首个治疗SMA的口服在研药物,作为一种运动神经元存活基因-2 (SMN2)剪接修饰剂,可以全身性地增加SMN蛋白。罗氏制药在全球范围内开展了有关risdiplam的4项多中心临床研究,入组SMA患者年龄分布广泛,包括不同分型的SMA患者。中国也同步加入了其中两项关键性临床研究FIREFISH和SUNFISH,这也是首次在国内开展SMA药物的临床研究。
目前,罗氏已公布了risdiplam的临床研究部分数。据数据显示,与自然史相比,接受risdiplam治疗的婴儿中实现独坐及无事件生存的比例显著提升。SUNFISH是一项在2型和3型SMA患者(2-25岁)中开展的关键性临床研究,数据显示,与安慰剂组相比,接受risdiplam治疗后的患者运动功能表现出显著改善,达到主要研究终点。Risdiplam在这两项试验中均展现出积极的临床疗效。迄今为止,在risdiplam的临床研究中均未观察到任何导致退出研究的药物相关安全性事件。
罗氏现已在全球其他7个国家及地区递交risdiplam的上市许可申请。美国食品药品管理局(FDA)已受理该药品的新药上市许可申请,并授予其优先审评资格。同时,罗氏制药预计在2020年年中向欧洲药品管理局(EMA)递交该药品的上市许可申请。
智通声明:本内容为作者独立观点,不代表智通财经立场。未经允许不得转载,文中内容仅供参考,不作为实际操作建议,交易风险自担。更多最新最全港美股资讯,请点击下载智通财经App
相关阅读
赛诺菲(SNY.US)Q1财报:明星药物Dupixent销售收入增长130%,中国市场收入下滑14%加速转型
2020-04-25 11:17
医药魔方
罗氏(RHHBY.US)Q1销售额同比增长7%至151亿瑞士法郎 预计全年销售额实现个位数增长
2020-04-22 15:40
程翼兴
美股快报 | 罗氏(RHHBY.US)Q1销售额为151亿瑞士法郎,同比增长7%
2020-04-22 15:18
程翼兴
艾伯维(ABBV.US)旗下伊布替尼获FDA批准扩展适应症,与利妥昔单抗联用成常见白血病一线疗法
2020-04-22 08:13
林喵
罗氏(RHHBY.US)“不限癌种”药物再次在中国申报三项临床试验
2020-04-20 16:06
李国坚



 扫码下载智通APP
扫码下载智通APP