新股消息 | 乐普生物估值超35亿元,拟明年Q1提交上市申请
本文来源于“医药合作投融资联盟”微信公众号。
乐普(北京)医疗器械股份有限公司(以下简称“乐普医疗”或“公司”)于 2018 年 1 月与公司实际控制人蒲忠杰先生控股的宁波厚德义民信息科技有限公司(以下简称:厚德科技)共同设立乐普生物科技有限公司(以下简称:乐普生物),公司持有乐普生物 20%股权。
为满足快速发展的需求,乐普生物计划 2020 年内进行 B 轮(pre-IPO)融资。资金主要用于产品研发、临床试验投入、生产线建设和营销团队组建。乐普生物计划 2021 年第一季度在国内资本市场或香港资本市场提交 IPO 上市申请。
2020年4约9日,乐普医疗发布公告,本次公司拟与深圳市拾玉投资管理有限公司、苏州民营资本投资控股有限公司等共 8 家投资机构共同向乐普生物增资4.5亿元,其中公司出资 9000 万元。增资后,乐普生物注册资本将由 100,000 万元增至 112,676.0564 万元,公司仍将持有乐普生物 20%股权;厚德科技拟将其持有的乐普生物 11.25%股权转让给上述 8 家投资机构,公司拟放弃该部分股权转让的优先受让权。
乐普生物最近一年一期的主要财务数据如下:
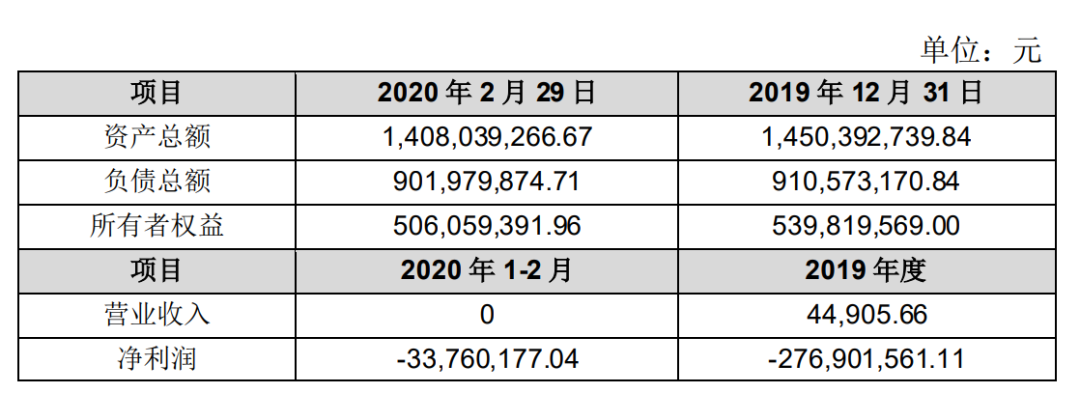
本次交易主要内容 经与交易相关方充分沟通,公司本次交易方案如下:
1、增资乐普生物 公司拟与深圳市拾玉投资管理有限公司、苏州民营资本投资控股有限公司等 共 8 家投资机构共同向乐普生物增资 45,000 万元,其中公司出资 9,000 万元。本次增资完成后,乐普生物注册资本由 100,000 万元增至 112,676.0564 万元,公司仍持有乐普生物 20%股权。
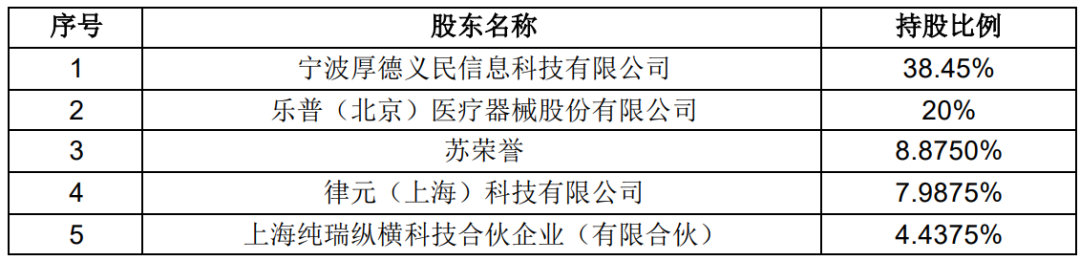
2、放弃股权转让优先受让权 增资完成后,乐普生物控股股东厚德科技拟将其持有的乐普生物 11.25%股 权,以 45,000 万元的交易对价转让给上述 8 家投资机构。公司拟放弃对乐普生 物 11.25%股权转让的优先受让权。增资及股权转让完成后,乐普生物股权结构如下:

1、定价依据:根据具有从事证券业务资格的蓝策亚洲(北京)资产评估有 限公司出具的评估报告(蓝策评报字【2020】第007号),截至评估基准日2020 年2月29日,乐普生物股东全部权益评估值为356,600.00万元。根据上述评估结果,经交易各方确认,本次增资以乐普生物整体估值355,000.00万元作为定价依据。
2、资金来源:本次增资乐普生物全部使用公司自有资金。
本次交易目的及对公司的影响
参与设立乐普生物,是公司经过审慎评估,前瞻性战略布局肿瘤免疫治疗领域而作出的决策。小股权参股,既降低了公司初期进入该领域的可能风险,同时也可享受乐普生物成功带来的巨大收益,为公司未来进入该领域开辟路径。 目前乐普生物产品研发、临床进展顺利,已建立起单双抗体、溶瘤病毒、抗体偶联药等多个生物药开发技术平台,多个产品在临床管线中稳步推进;同时产业平台建设有序进行,北京生产基地已经投入使用,上海生产基地正在建设中。本次增资乐普生物,符合公司长期发展战略,有利于提升公司未来在肿瘤免疫治疗领域的核心竞争力,增强公司长期发展新动能。
乐普生物科技有限公司肿瘤免疫治疗项目进展
乐普生物科技有限公司(以下简称“乐普生物”)成立于 2018 年 1 月。公司围绕肿瘤免疫治疗和靶向药物,建设创新型肿瘤治疗产品平台;同时搭建覆盖靶点发现、成药研制、开发和生产的开放性产业平台。通过产业平台和产品平台 的协同作用,实现乐普生物的跨越式发展和可持续发展。
目前公司产业及产品平台布局情况如下:
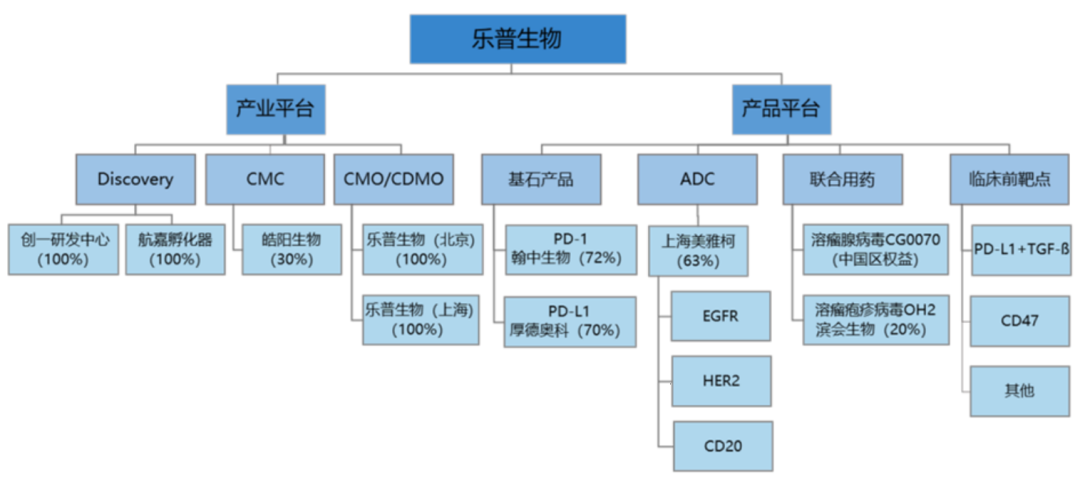
一、公司产品管线
乐普生物通过自主研发、合作引进、投资并购等方式,围绕肿瘤免疫治疗和 靶向药物已构建丰富的产品管线。
公司产品管线如下:
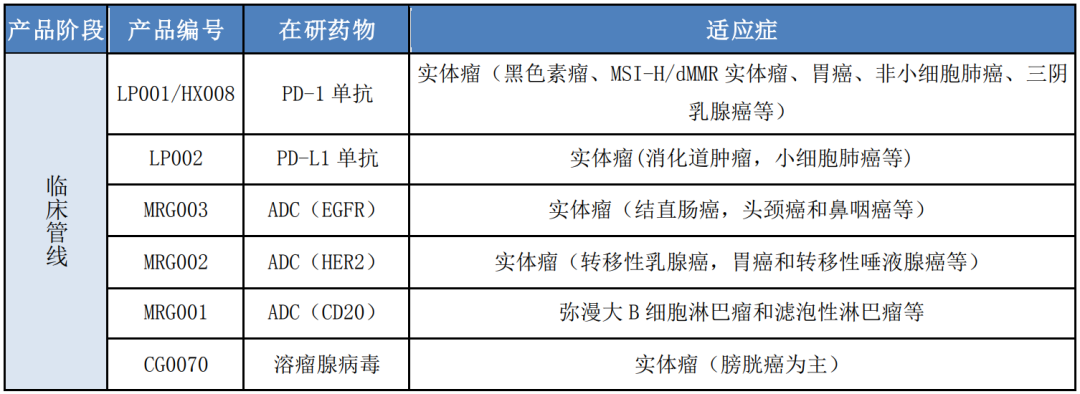
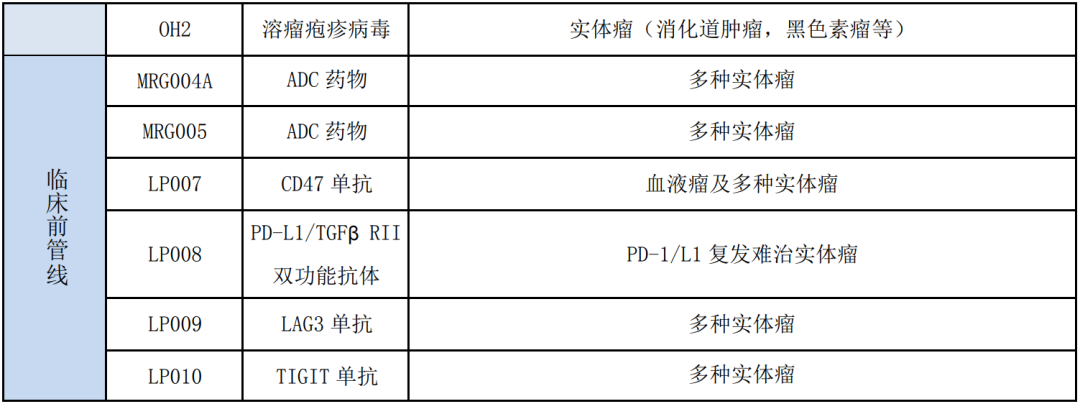
二、临床管线产品进展
公司目前已有 7 个产品进入临床研究阶段,主要开展的适应症和进度如下:
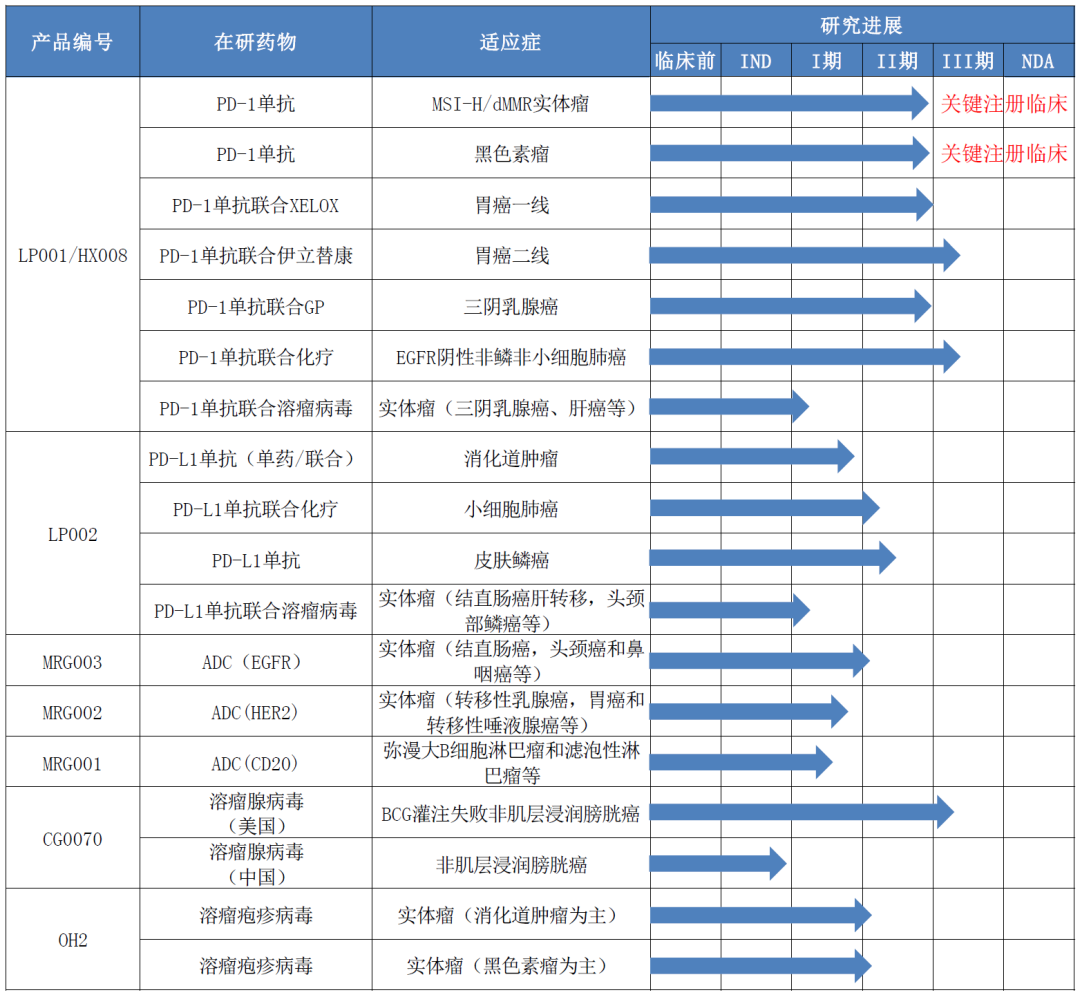
1、PD-1 单抗:
乐普生物控股公司泰州翰中生物医药有限公司的 PD-1 创新型单抗药物 (HX008 注射液)已开展多个适应症的 II 期临床研究,其中晚期黑色素瘤和微卫星高度不稳定(MSI-H)或基因错配修复缺陷型(dMMR)晚期实体瘤为关键性 II 期临床注册研究,计划于 2020 年第三季度提交 NDA 申请。
截至 2020 年 3 月,PD-1 用药患者已超过 315 例,初步临床研究结果显示 HX008 安全性良好、有效性优异。多个适应症的临床 II 期研究阶段性疗效评估结果如下:

HX008 在多个适应症上的初步临床研究结果显示其疗效数据优于同靶点药物帕博利珠单抗的已发表数据。为进一步扩大 HX008 临床适应症,公司已开展两个 III 期临床研究,分别为 PD-1 单抗(HX008)联合化疗对比帕博利珠单抗联合化疗作为一线方案治疗 非鳞非小细胞肺癌的 III 期临床研究及 PD-1 单抗 HX008 注射液联合伊立替康治疗经一线化疗失败后的晚期胃腺癌的 III期临床研究。另外, PD-1 单抗与溶瘤病毒的联合临床研究已于 2020 年 4 月 7 日获得临 床批件(批件号:CXSL2000011),主要适应症为实体瘤。PD-1 单抗与溶瘤病毒的联合治疗方案将形成具有独特优势的肿瘤免疫治疗产品组合,提高公司未来 在该领域的核心竞争力。PD-1 单抗药学研究目前正在鼎康生物(原喜康生物)开展,已完成工艺开发、产品表征及相关质量研究,即将开展 2000L 商业化规模的三批工艺性能确认研究(PPQ),并配合 NDA 申报和获批初期的商业化生产。同时,乐普生物位于上海浦江镇的生产基地也正在建设中,前期将配套两条符合 GMP 要求的商业化生产线,每条生产线将配置 3x2000L 的生产规模,预计于 2021 年 4 月可 正式投入使用,并将 PD-1 单抗项目逐步转移至上海生产基地进行商业化生产。
2、PD-L1 单抗:
乐普生物控股公司泰州厚德奥科科技有限公司的 PD-L1 创新型单抗药物 (LP002 注射液)已进入 I/II 期临床研究,目前已完成 I 期实体瘤的耐受性及药代动力学研究,正在开展晚期一线小细胞肺癌和晚期皮肤鳞状上皮细胞癌两个 II 期临床研究。PD-L1 单 抗与 溶 瘤 病毒 联 合 临床 研 究 已获 得 临 床批 件 (批 件 号 :CXSL1900128)。目前该联合研究方案已获得伦理批准,即将开展多个实体瘤适应症的临床研究。
3、ADC-抗体偶联药物:
乐普生物控股的上海美雅珂生物技术有限公司拥有抗体偶联药物(ADC)开 发平台以及多个临床和临床前开发阶段的 ADC 靶向药物,并获得荷兰 Synaffix 公司的新一代定点偶联技术的商业化权利。目前临床研究阶段的三个 ADC 药物分别靶向 EGFR(MRG003)、HER2 (MRG002)和 CD20(MRG001)。
(1)MRG003 是靶向 EGFR 的 ADC,目前已完成 Ia 期爬坡阶段,安全性良好,对 EGFR 阳性的晚期转移性的结直肠癌(mCRC)、头颈癌和鼻咽癌均显示初步疗效,目前正在开展 1b 期扩展临床研究,进一步证明其安全性和有效性。
(2)MRG002 是靶向 HER2 的 ADC,目前正在 Ia 期爬坡临床研究阶段, 安全性良好,对 HER2 阳性的赫赛汀耐药的转移性乳腺癌,胃癌和转移性唾液 腺癌患者在不同剂量组均显示显著疗效,已有疗效评估的患者疾病控制率 (Disease Control Rate, DCR 包括 PR+SD)达到 92.3%。
(3)MRG001 是靶向 CD20 的 ADC,目前正在 Ia 期爬坡临床研究阶段, 已经测试的三个剂量组显示安全性良好,并且在美罗华耐药的滤泡性淋巴瘤(FL) 中已经显示初步药效,目前包括弥漫大 B 细胞淋巴瘤(DLBCL)和滤泡性淋巴 瘤(FL)在内的复发/难治的 B 细胞非霍奇金淋巴瘤(B-NHL)仍然在入组中。
4、溶瘤病毒:
(1)溶瘤腺病毒:乐普生物引进了美国 Cold Genesys 公司的溶瘤腺病毒 CG0070,并获得其在中国区的产品开发权益和全球供货权益。CG0070 在美国 已经完成了治疗 BCG 灌注失败的非肌层浸润膀胱癌患者的 II 期临床研究,临床 疗效显著:6 个月 CR 率为 45%,12 个月 CR 率为 30%;目前正在美国开展该适应症的 III 期临床研究。同时,乐普生物正在开展该产品在国内的 IND 申报工作。
(2)溶瘤疱疹病毒:乐普生物参股公司武汉滨会生物科技股份有限公司的重组人 GM-CSF 溶瘤 II型单纯疱疹病毒(OH2)注射液(Vero 细胞)已完成 Ia 期临床研究。结果显示其安全性良好,未出现 3 级以上相关 SAE;并在黑色素 瘤、食管癌和结直肠癌肝转移等患者中显示初步疗效。公司也将积极开展 PD-1 和 PD-L1 单抗与溶瘤病毒在不同实体瘤上联合用药的临床研究。
三、 临床前产品研发管线进展和布局情况
乐普生物致力于新的免疫检查点药物的临床前开发,围绕肿瘤免疫循环尽可能释放肿瘤免疫治疗的潜力,并用以解决 PD-1/L1 药物响应性不足或耐药的临 床问题。目前公司研发中心正在着手开发LP007(CD47 单抗),LP008 (PD-L1/TGFβRII 双功能抗体),LP009 (LAG3 单抗)和 LP010(TIGIT 单抗)。LP007 (CD47 单抗):CD47 在多种血液肿瘤和实体瘤细胞上高表达,是巨 噬细胞上重要的免疫检查点。LP007 是针对 CD47 的特异性抗体,具有不诱导 红细胞凝集的特性,在保持有效抗肿瘤活性的同时具有较好的安全性;目前处于毒理学研究阶段。
LP008 (PD-L1/TGFβRII 双功能抗体):TGFβ 信号通路特异激活与患者对 PD-1/L1 抗体不响应有关,并在免疫排斥型肿瘤的免疫逃逸中起到重要作用。LP008 是 PD-L1/TGFβ RII 双功能抗体,能同时阻断 PD-1/L1 信号和在肿瘤微环境中结合游离 TGFβ 并阻断 TGFβ 信号,达到安全性和有效性的最佳平衡。LP008 在临床前肿瘤动物模型中展现了优异的抗肿瘤活性,同类产品在早期临 床中显示了安全性和初步有效性;目前处于工艺开发阶段。
LP009 (LAG3 单抗):LAG-3 是目前免疫检查点二代靶点中,临床数据较 多、成药性相对确定的靶点。临床研究数据表明 LAG3 单抗与 PD-1 单抗联合治疗在 PD-1 复发难治的黑色素瘤中展现了良好的药效。LP009 是高亲和力的 LAG3 单抗,目前处于临床前开发阶段。
LP010 (TIGIT 单抗):TIGIT 是表达在 NK、CD8 杀伤细胞以及调节性 T 细 胞上的免疫检查点。目前发表的临床研究表明,TIGIT 单抗与 PD-1 单抗联合治 疗在一期临床展现良好的安全性。LP010 是高亲和力的 TIGIT 单抗,目前处于 临床前开发阶段。临床前开发阶段的 MRG004A 和 MRG005 是针对新靶点的 ADC 药物,目 前均处于 GLP 毒理学研究阶段,在动物模型中对多种肿瘤显示显著的肿瘤生长 抑制作用。公司计划未来 6-12 个月内申报 IND,主要用于治疗宫颈癌、三阴乳腺癌,胰腺癌和胃癌等。
四、 公司产业平台情况
为建设产业化能力、加速产业化进程,乐普生物搭建了覆盖靶点发现、成药研制、开发和生产的开放性产业平台。
1、 新药研发平台:乐普生物设立了乐普创一生物科技有限公司,作为公司新靶点药物的研发平 台,致力于开发新的肿瘤免疫治疗方案。乐普创一将基于双特异抗体平台打造 T 细胞、NK 细胞招募抗体以及免疫细胞因子,用以治疗免疫治疗不响应的“冷” 肿瘤。为持续提供创新动能,公司设立了乐普航嘉(上海)创业孵化器管理有限公 司。孵化器拥有抗体/重组蛋白类生物创新药早期开发的全套实验室设备,可以开展从分子、蛋白到细胞水平的各类实验。目前,孵化器已入驻三个新靶点药物研发团队。
2、生产基地(CMO/CDMO)建设进展情况:为保障产品质量和未来的商业化供应,乐普生物在北京、上海建设了两个国 际标准的抗体生产基地。北京抗体生产基地已经完成建设,并取得北京市药监局 颁发的 “药品生产许可证”。1*2000L 的抗体生产线已经投入使用。上海生产基 地正在建设中,一期建筑面积 10.8 万平方米,目前已经完成地基及地下室的施 工建设。公司计划于 2021 年 4 月建成 2 条 3*2000L 的抗体生产线。
3、CMC 工艺开发平台:公司参股的杭州皓阳生物技术有限公司主要为乐普生物和国内外新药公司、 制药企业提供生物药物人源化、成药性和临床前 CMC 开发服务。该公司由来自药明生物、诺华等生物制药研发领先企业的技术骨干创立,具备丰富的抗体/重 组蛋白药物开发经验。公司成立四年来,已完成二十余个高表达稳定细胞株构建项目和多个 IND 申报项目。公司位于杭州市余杭经济技术开发区,拥有 5000 平 方高标准研发实验室,并具备符合 GMP 要求的抗体药物原液生产中试车间。公司是国家高新技术企业,浙江省企业研发中心,并和中国药科大学、大连理工大 学、浙江理工大学等建立了学生联合培养合作。
五、融资及上市计划 为满足快速发展的需求,公司计划 2020 年内进行 B 轮(pre-IPO)融资。资金主要用于产品研发、临床试验投入、生产线建设和营销团队组建。公司计划 2021 年第一季度在国内资本市场或香港资本市场提交 IPO 上市申请。
(编辑:文文)



 扫码下载智通APP
扫码下载智通APP