宝新金融:CRO/CDMO 行业是如何应运而生的?
本文来自宝新金融。
CRO/CDMO 行业是如何应运而生
全球医疗行业平稳向好态势不变在 20 世纪,小分子化学药在西方爆发式成长,重磅药不断出现。中西方在药物研发有着不同步伐,但相同的是研发投入才是致胜关键。受不断增加的医药研发支出,以及不断提高的研发效率需求推动, CRO/CDMO 行业在产业链复杂化及精细化的背景下应运而生,无论是化学药还是生物药,外包医药研发予外部服务供应商的趋势都在持续下去。此报告专注于对 CRO/CDMO 行业前景的探讨。
CRO/CDMO 行业进入快速发展阶段目前中资外包服务行业存在着碎片化及同质化的问题,与国外企业有一定差距,随着中国投放更多资源于创新药研发,长远而言会扩展服务内容,从重量转向重质。当前的天时(创新药研发加快)地理(中国成本比西方低)人和(理工科人才辈出)正带领中国 CRO 行业进入快速发展阶段,正如西方当时的重磅药时代,跨国 CRO 的发展历程对于中国企业来说具有高参考意义。
集资活动支持行内并购及环球布局从药物发现到商业化,CRO/CDMO 业务的异质性大,而且随着药物结构变得复杂,所要求的技术不断提升,企业难以在短时间内同时符合多种要求,因此要通过一系列的并购整合实现高速增长。十年间,国内 CRO 市场起飞,纷纷上市集资,投放资源于研发及进行收购,未来行业将继续进行横向及纵向并购,以及在环球布局方面更为积极。
药明生物(02269)值得长期关注药明生物强大的技术领先地位、持续改进的技术能力、优秀的过往记录及卓越的质量体系推动着它在全球及中国获得更多市场份额,集团“跟随药物分子发展阶段扩大”加上“提供全球双厂生产的长期全球化策略”正为生物技术行业带来创新与变革,能加快产品上市,以及降低生产成本。现时集团的北美、欧洲和中国的三大市场都在快速发展,收入及盈利均录高增长,支持着药明生物的高估值。

1. 全球药品市场规模
近年来全球医药市场一直稳步发展,市场规模由 2014 年的 10,425 亿美元增至 2018 年的 12,674 亿美元,复合年增长率为 5.0%,预期 2023 年将达 15,953 亿美元,复合年增长率为 4.7%。随着更多全球医药及新兴生物科技公司投入巨资进行创新药物研发以及个性化医疗的发展趋势,全球创新药物市场规模由 2014 年的 7,384 亿美元增至 2018 年的 8,487 亿美元,预期 2023 年将达 10,345 亿美元。在人口老化、都市病、传染病疫症变得普遍的大背景下,人类对医药的需求持续增加,与此同时,专理悬崖使药商加快研发速度,Me-too、 Me-better、First-in-class 的药物推出都正在加快,CRO/CDMO 行业是时代下的产物。
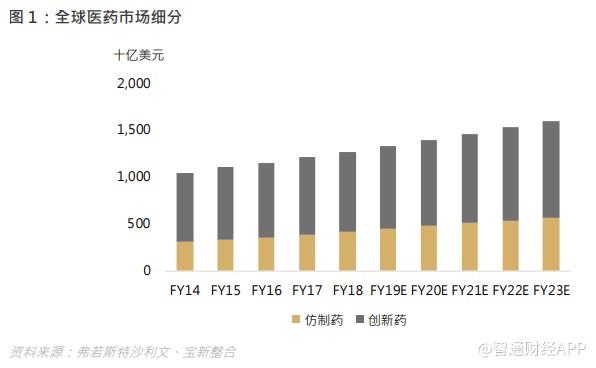
在 20 世纪,小分子化学药在西方爆发式成长,重磅炸弹药不断出现。中西方在药物研发有着不同的步伐,但相同的是研发投入才是致胜关键。随着集中采购仿制药政策推出,以及创新药物纳入国家医保药品目录 (National Drug Reimbursement List),中国医药市场转向创新药物研发为大势所趋。于 2018 年中国创新药物市场已占医药市场总量的 55.5%,同时中国创新药物市场增速超过全球平均水平,由 2014 年的 1,065 亿美元增至 2018 年的 1,286 亿美元,复合年增长率为 4.8%,预期 2023 年将达 1,844 亿美元,2018 年至 2023 年的复合年增长率为 7.5%,超过中国仿制药市场的增长率。
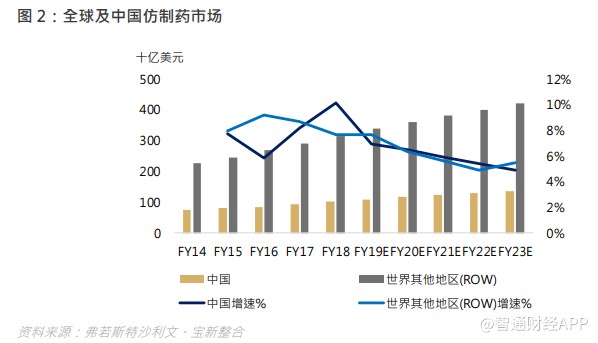
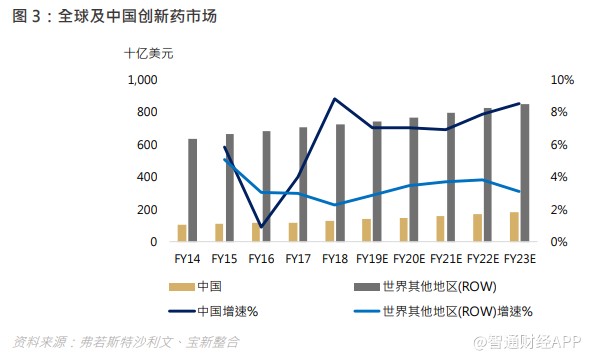
国内带量采购政策下,仿制药的盈利空间压缩逼使药商需在新领域创造更多空间,我国是一个新药研发刚刚起步的国家,在政策倒逼下,新药研发领域的机遇将逐步涌现,长期来看,中国药企布局 me- too、me- better、 first-in class 的研发路径仍然方兴未艾。而全球药企布局方面,生物药的研发热度正在攀升。化学药与生物药的主要区别在于,后者主要从靶点出发,使得药效较高,凭借生物药卓越的疗效、生物科技的显著发展以及研发投入不断增加,全球生物药市场在 2013 年至 2017 年期间实现了快速增长,复合年增长率为 7.4%。中国生物药市场仍处于发展初期,具有强劲的增长潜力,从 2013 年占中国整体医药市场的 8.7%增至 2017 年的 15.3%。
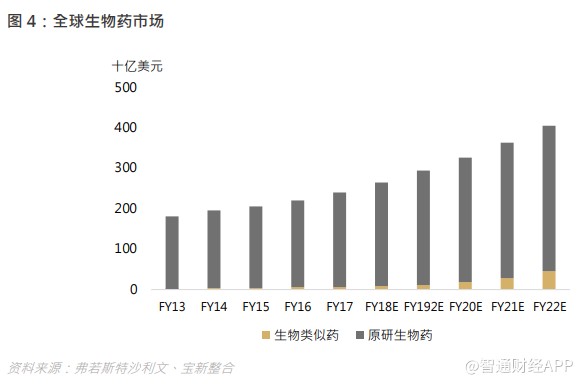
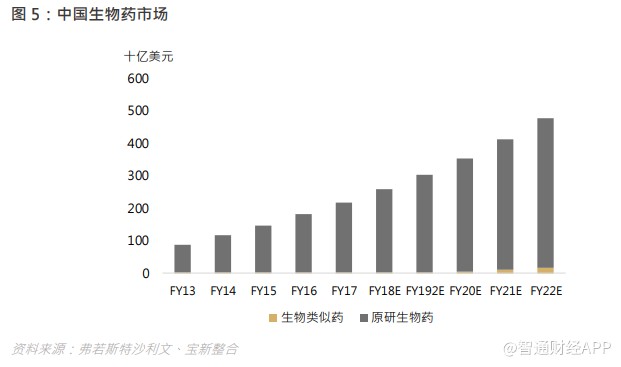
受不断增加的医药研发支出、扩展及客制化的研发服务,以及不断提高的研发效率需求推动,CRO/CDMO 行业在产业链不断复杂化、精细化的背景下应运而生,无论是化学药还是生物药,外包医药研发予外部服务供应商的趋势都会持续下去。此报告专注于对 CRO/CDMO 行业前景的探讨。
2. 医药研发服务市场概览
医药研发服务主要分为两类:合同研发服务(CRO)及合同生产服务(CMO/CDMO)。合同研发服务提供的服务通常涵盖药物发现、临床前及临床阶段的多项科技功能。另一方面,合同生产服务提供的服务主要涵盖商业化生产以及工艺/配方开发,以支持临床前及临床阶段。
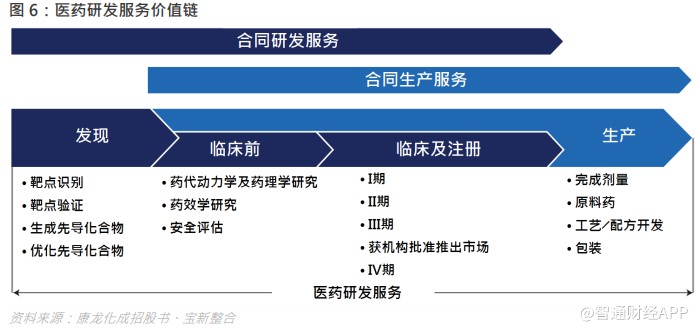
药物发现:此阶段主要涉及靶点筛选、化合物的发现及筛选等几个步骤,以得到相应的候选药物;
临床前 CRO:药理学是研究药物与机体间相互作用规律与其原理,主要包括药效动力学和药代动力学两个方面。前者是阐明药物对机体的作用和作用原理,后者阐明药物在体内吸收、分布、生物转化和排泄等过程,及药物效应和血药浓度随时间消长的规律。毒理学需要评估急性毒性、长期毒性、生殖毒性、致癌试验等。
临床 I 期试验:临床药理和毒性作用试验期。初步的临床药理学及人体安全性评价试验,观察人体对于新药的耐受程度和药代动力学,为制定 II 期试验给药方案提供依据,试验对象为健康志愿者。
临床 II 期试验:治疗作用初步评价阶段。其目的是初步评价药物对目标适应症患者的治疗作用和安全性,也包括为 III 期临床试验研究设计和给药剂量方案的确定提供依据。此阶段的研究设计可以根据具体的研究目的,采用多种形式,包括随机盲法对照临床试验。
临床 III 期试验:将获得更多的药物安全性和疗效方面的数据,对药物的益处/风险进行评估。
2.1 全球合同研发服务市场
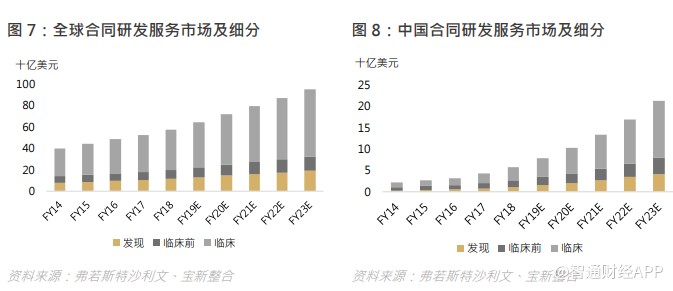
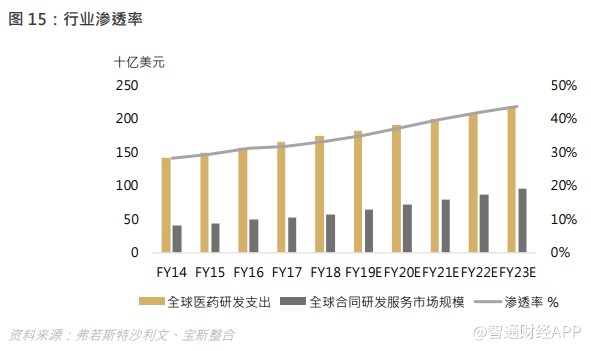
根据弗若斯特沙利文,全球合同研发服务市场规模由 2014 年的 400 亿美元增至 2018 年的 579 亿美元,复合年增长率为 9.7%,预期 2023 年将达 952 亿美元,复合年增长率为 10.5%。全球合同研发服务市场渗透率(按占全球医药研发支出的百分比计量)由 2014 年的 32.6%增至 2018 年的 37.2%,当中,药物发现服务的渗透率由 2014 年的 28.8%增至 2018 年的 35.2%,而临床前及临床开发服务的渗透率则由 2014 年的 33.7%增至 2018 年的 37.7%,全球合同研发服务的渗透率正持续上升。
中国合同研发服务市场规模由 2014 年的 21 亿美元增至 2018 年的 59 亿美元,复合年增长率为 29.2%,增速高于全球平均水平,渗透率(按占中国医药研发支出的百分比计量)由 2014 年的 27.4%增至 2018 年的 35.8%。
2.2 全球合同生产服务市场
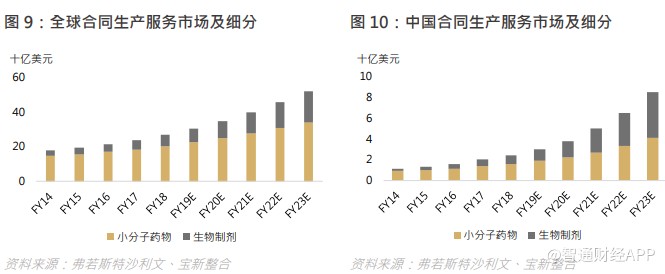
合同生产服务市场包括生产小分子药物及生物制剂的服务。全球合同生产服务市场规模由 2014 年的 179 亿美元增至 2018 年的 268 亿美元,复合年增长率为 10.7%,当中,小分子药物的合同生产服务市场由 2014 年的 147 亿美元增至 2018 年的 204 亿美元,而生物制剂的合同生产服务市场则由 2014 年的 31 亿美元增至 2018 年的 64 亿美元。
中国合同生产服务市场规模由 2014 年的 12 亿美元增至 2018 年的 24 亿美元,复合年增长率为 19.8%,当中,小分子药物的合同生产服务市场由 2014 年的 9 亿美元增至 2018 年的 16 亿美元,而生物制剂的合同生产服务市场则由 2014 年的 2 亿美元增至 2018 年的 8 亿美元。中国市场增速远高于全球平均水平,尤其是生物制剂方面。
2.3 全球生物制剂研发服务市场概况
生物制剂研发服务特别针对生物制剂市场,过程一般涵盖五个阶段:药物发现、临床前开发、早期(第 I 及 II 期) 临床开发、后期(第 III 期)临床开发、及商业化生产。生物制剂开发过程具有资本密集、复杂性及高度技术性的特点,特别是在商业化阶段,促使了越来越多制药及生物技术公司转向外包。
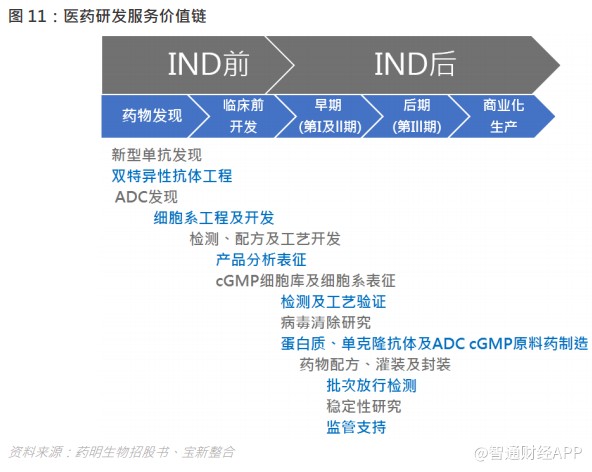
发现:候选生物制剂药物被识别且部分经验证可治疗特殊病的过程。整体过程通常包括目标验证、筛选制备、生成及导联选择、导联优化及表征及在研药物选择。
临床前开发:在人体内临床测试药物前进行的体内外研究。于此阶段,实验室及动物研究或可用于评估药物的安全性及显示其对目标疾病的生物活性。临床前测试的目标是取得将能使临床前在研药物获适当监管机构批准进行人体测试的结果。
临床开发:对客户进行的临床试验,提供单抗/重组蛋白/抗体偶联药物 cGMP 原料药制造、批次放行检测及稳定性测试、灌装及封装及监管支持等临床开发服务。确定安全性及疗效的潜在在研药物的临床试验或人体测试包括第 I 及 II 期临床试验(早期试验)及第 III 期试验(后期试验)。成功的临床试验通常将使得向监管机构备案生物制剂许可证申请,以寻求营销该药物的批准。
商业化:一经药物取得所有必要批文,或会开始生产、营销及商业化销售大量获批准药物。生产过程通常包括细胞培养、采集、净化、储存及装运。一经与生物制剂研发服务供货商确定商业化生产,更换外包供货商将会产生巨额成本。
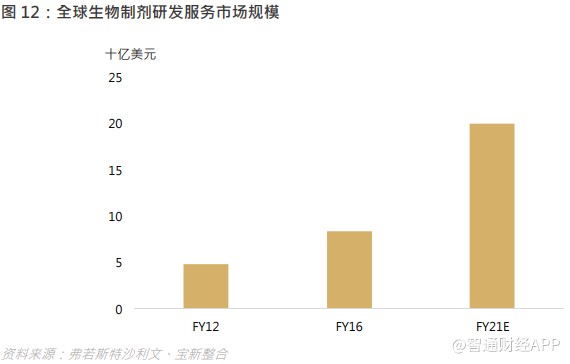
以市场规模计,全球生物制剂研发服务市场由 2012 年的 48 亿美元增加至 2016 年的 84 亿美元,复合年增长率为 14.9%。
2.4 受惠全球医药研发支出增加
整体而言,CRO/CDMO 行业增长是因为全球医药研发支出增加,以及渗透率增加。前者受惠于行业投融资景气度提升,而后者是由于 CRO/CDMO 服务的使用有助提升药商的效率。
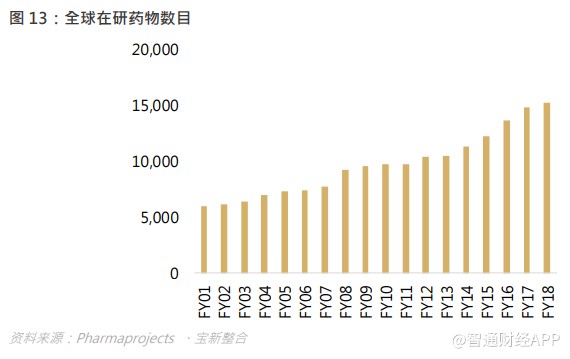
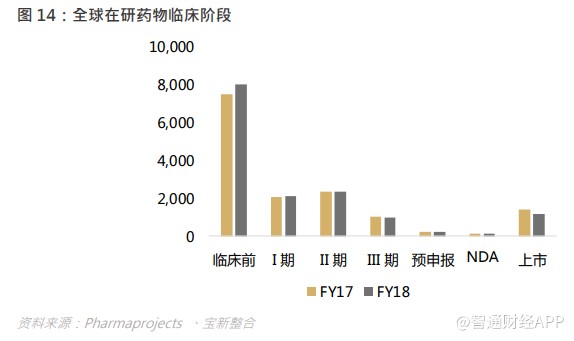
根据 Pharmaprojects 统计,2018 年全球新药研发管线数量达到 15,267 个,从临床阶段来看,超过一半的研发管线集中在临床前阶段,2018 年共 8,040 个,同比增长 7.3%。
全球研发支出不断增加,预期未来数年该增长趋势将持续下去,主要是由于资本投资增加、创新技术发展、在研候选药物数量增加、创新药物医药研发所需资源增加、及医疗需求未能得到满足。全球研发支出由 2014 年的 1,416 亿美元增至 2018 年的 1,740 亿美元,复合年增长率为 5.3%。
2.5 CRO 行业渗透率提高
研发复杂度及成本增加,导致研发/生产外包服务渗透率逐步提升。对于大型跨国药企来说,外包服务可节省研发成本及缩短研发周期;与此同时,在初创企业逐渐成为研发主力的趋势下,对于 CRO 的依赖度进一步增加,这是由于 Biotech 企业通常人员精简,自身缺乏完整的全周期研发能力,难以通过自身完成后续新药研发的全部环节,随着新兴 Biotech 的占比提高,CRO 行业渗透率持续增加。
3. CRO/CDMO 服务存在的意义
受不断增加的医药研发支出、扩展及客制化的研发服务,以及不断提高的研发效率需求推动,CRO/CDMO 行业在产业链不断复杂化、精细化的背景下应运而生,多年来我国理工科毕业生众多,人才不缺,相对全球来看具工程师红利这优势,而且从 2001 年起,中国加入世贸组织,改善了对药品专利的保护力度,相对印度的「药品专利强制许可」,国际药企都较放心的将研发/制造外包给中国 CRO/CDMO 企业。
3.1 政策利好
在 2003 年我国颁布了《药物临床试验质量管理规范》,明确规定申办者可以委托合同研究组织执行临床试验中的某些工作和任务,在法律上确立了 CRO 公司的地位,国内 CRO 行业进入高速发展阶段。此后泰格医药、美迪西、博腾股份等陆续成立。直至 2015 年,国家食药监总局发布《关于开展药物临床试验数据自查核查工作的公告》,彻底根治药物临床数据不真实、不规范等问题,行业重质不重量的需求推动了国内 CRO 的发展。同时 MAH 政策(Marketing Authorization Holder)的催化下,药品研发和生产环节可分离,商业化阶段的外包率提高,引领着 CMO/CDMO 进入高速发展阶段。
3.2 成本优势
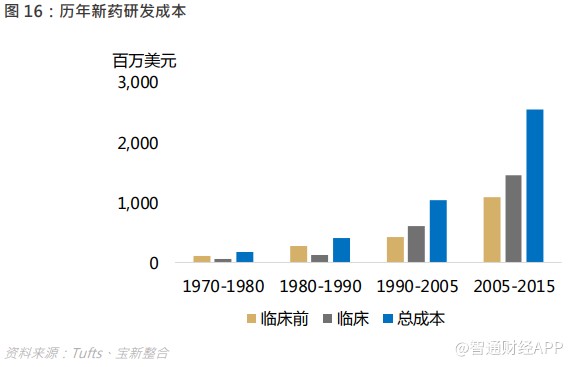
在 21 世纪,新药研发难度提升,平均研发成本由 80 年代的 1.8 亿美元增至 2015 年的 25.6 亿美元,药企有迫切需要降低成本,中国的工程师红利让中国 CRO 企业有着成本优势。
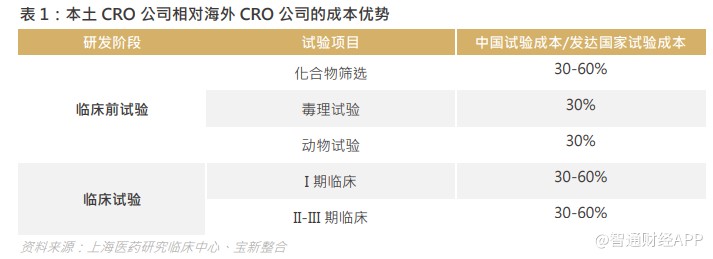
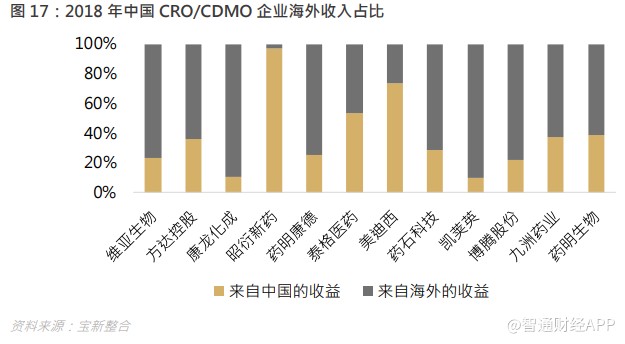
中国试验成本相对发达国家试验成本低 30-60%,因此对于要节省成本的欧美药企来说非常吸引,中国的工程师红利一直吸引着海外研发订单转移,多家国内 CRO 企业的收入都以海外收入为主。
3.3 专业化分工有利于提升效率
药物研发是一项高风险、高技术、长周期和精细化的过程,一种新药的研发可能需要数十亿元以及数十年的时间。药企若要独自承担新药研发阶段的所有环节,其人员及设备的投入将极庞大,但 CRO/ CDMO 企业往往可利用其规模优势,及丰富的经验提高研发效率与商业化进度,大幅缩短新药的研发流程及成本。
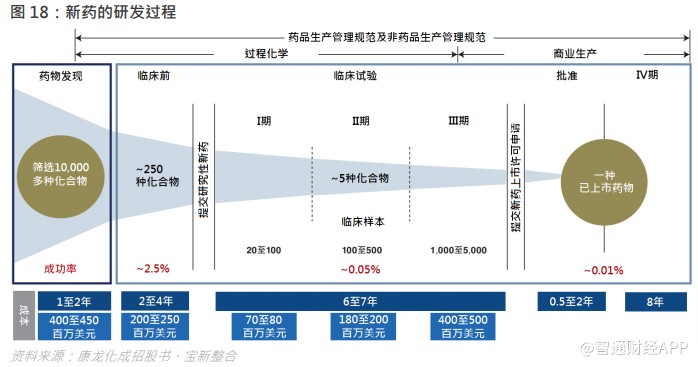
CRO 企业能够有效降低成本,提高研发效率:新药研发的流程复杂,倘若整个研发流程都以内部团队完成,成本及时间效益将未如理想,相反,CRO 企业具有大量丰富的研究、数据分析及注册经验,有 CRO 参与的药品研发一般能够缩短 25- 40%的研发周期。
CMO/CDMO 企业能够有效降低成本,提高研发及生产效率:在 MAH 制度下药企药品研发和生产环节可分离,减少了资本支出与资金需求,相比药企自主投资进行产能建设的效率为高。CMO / CDMO 企业具有高通用性的生产能力,进行大量新药开发及商业化阶段原料药、中间体及制剂的生产,产能利用率比药企高,规模效应有助降低成本。
3.4 生物药时代推动生物药 CDMO 发展
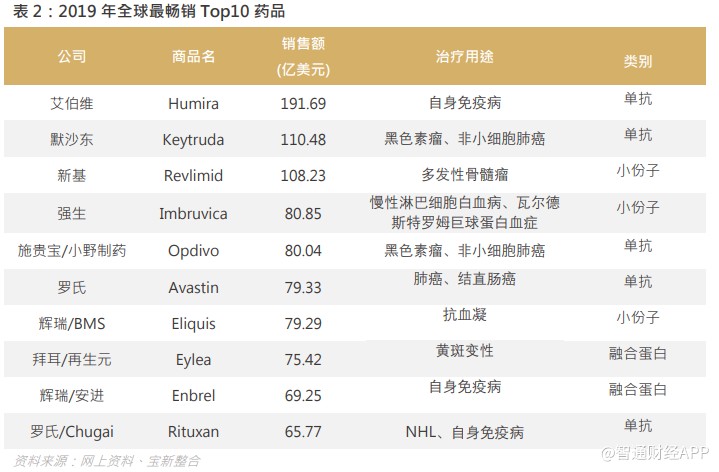
随着药物研发从化学药时代逐渐进入生物药时代,单抗、细胞治疗、基因治疗等研发方向将占据更重要的位置。 2019 年全球最畅销 Top10 药品榜单上,小份子药仅有三席之地,其余全都是生物药,其中单抗类药物占据了 5 席之多。
生物制剂在药物发现、临床前研发、临床试验、商业化生产方面对比传统化学药有一定的差异。生产生物制剂的大分子的脆弱性及活细胞的敏感度,带来对生物制剂发现、开发及制造的复杂技术要求。此外,生物制剂分子体积大且复杂,增加了制订相应测试方法以分析这些产品时进行质量控制的挑战。高技术要求令生物药 CDMO 企业能够发挥更重要作用。
对药厂而言,建立生物制剂开发能力及设施(特别是临床与商业化生产设施)高度资本密集及费时。例如,生物制剂产品开发商将须提前约三至五年兴建设施以筹备产品审批及推出。通过委聘生物制剂研发服务供货商,制药及生物技术公司可节省庞大投资金额并加快生物制剂产品的发现、开发及商业化,达至巨大的成本及时间节省效益。
4. 全球行业格局
自 19 世纪开始,西方在药物研发作出了伟大贡献,药品如阿司匹林都于当时诞生,时代的推进引领临床试验、新药研发、药效监管等产生了规范,药商为加快推出新药而用到外包服务,因此现时绝大部份外包行业龙头都是外资企业,有着多年经验积累,龙头企业能提供一站式的平台服务,覆盖药物研发到药物上市各个流程。另一边厢,中国创新药研发历史较短,中资外包服务行业分散,存在着碎片化及同质化的问题,服务集中于提供技术要求较低的临床前服务及临床 I 期服务,至于在核心技术上(例如临床数据管理系统、数据分析统计等),与外资比较还是有一点差距,但正因如此,中国的外包行业正在处于快速增长的阶段。
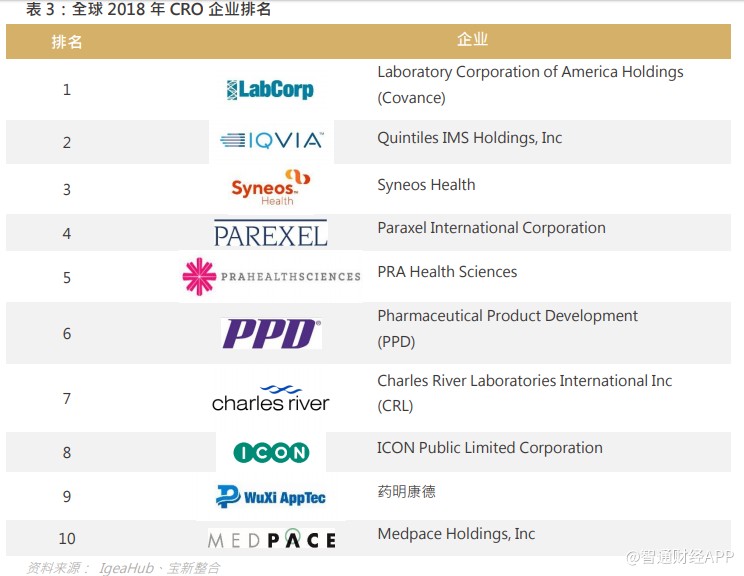
若按收益计算,排名前 15 的 CRO 及 CMO/CDMO 于 2017 年占全球药物研发外包服务市场份额的 27.1%,当中只有药明康德是中资企业。榜上的大型 CRO 及 CMO/CDMO 包括 IQVIA、Covance、Paraxel、ICON 及 Charles River,主要致力于临床研究服务。药明康德为亚洲最大的药物研发服务平台,于 2018 年占全球药物研发外包服务市场份额的 2%。
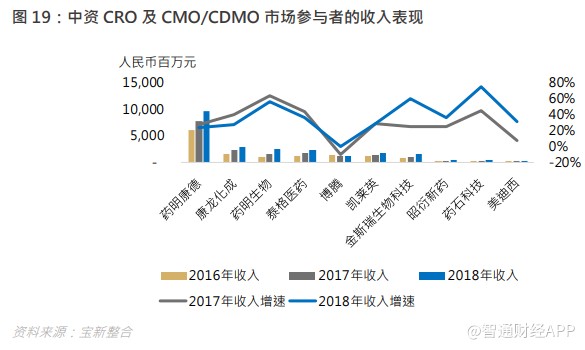
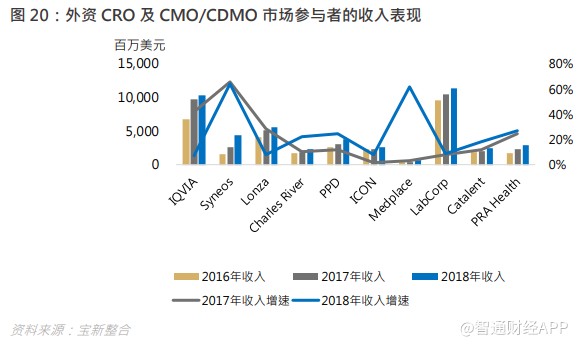
整体方面,各企业的收入及盈利增长普遍不俗,反映行业景气度持续向上,人类对药物的需求恒久不变。
5. 行业发展方向
5.1 国内企业将追求平台一体化
目前中资外包服务行业存在着碎片化及同质化的问题,服务集中于提供技术要求较低的临床前服务及临床 I 期服务,只有药明能提供一站式服务,因此与外国企业有一定差距,随着中国投放更多资源于创新药研发,长远而言行业会扩展服务内容,从重量转向重质。当前的天时(创新药研发加快)地理(中国成本比西方低)人和(理工学生人才辈出)正带领中国 CRO 行业进入快速发展阶段,正如西方当时的重磅药时代,跨国 CRO 的发展历程对于中国企业来说具有参考价值。
从收入来看,IQVIA 和 Covance 是目前全球最大的两家 CRO 公司,之后 Syneos Health、Parexel、PRA、 PPD、ICON 的规模相若。
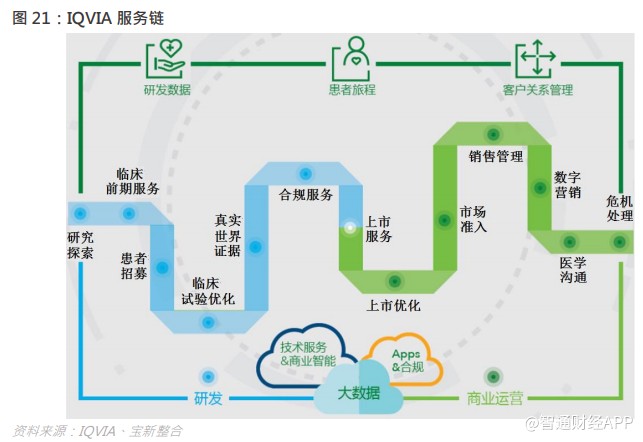
IQVIA IQVIA
在临床 CRO 业务上具领导地位,公司业务覆盖全球百多国家,实现了全球范围内的业务覆盖,IQVIA 是于 2016 年由 CRO 行业龙头 Quintiles 与医疗健康咨询公司 IMS Health 合并后组建成,其服务覆盖多个临床环节,提供一体化解决方案,包括患者招募、临床试验优化、合规服务、上市服务,自从与 IMS 合并后更可用大数据优势,利用真实世界数据网络和已有的数据库,提供药品的全方位数据,利用患者医疗数据、临床试验结果等去确定及量化各种干预方案的优势,风险和结果,为客户提供基于真实世界数据的决策。
Covance Covance
是全球业务覆盖最全面的 CRO / CMO 企业,1997 年从康宁公司(Corning)分拆出来独立运营,2015 年被 LabCorp 收购,成为其医药研发服务部门。公司服务包括从药物发现、临床前研究、临床研究、上市申报、生产支持、上市后监测的全流程服务。相对其他竞标对手,Covance 产业链布局更加完整,可提供全生命周期服务,如化合物优化,药理毒理试验试验等,并同时覆盖小分子、生物制剂、生物类似药研究服务,因此在全球服务领先。

从 IQVIA 及 Covance 的发展历程可见要在行业突围而出,业务覆盖面以及数据处理能力都是致胜关键之一。現时国内外包服务同质化严重,CRO 企业要在创新浪潮中蜕变,平台化将成大势所趋。
5.2 海外并购
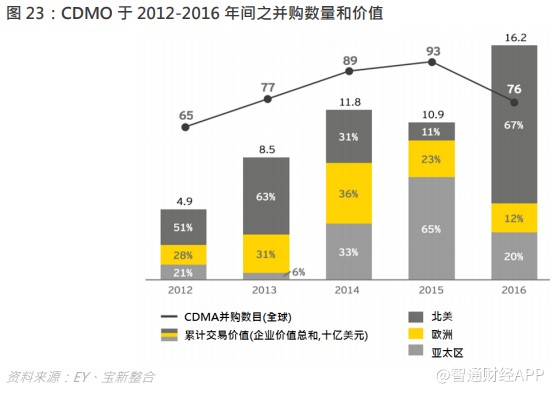
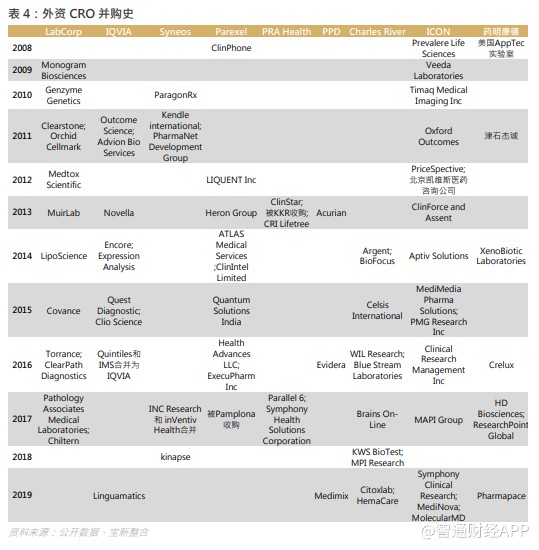
CRO/CDMO 业务的异质性大,而且随着药物结构变得复杂,所要求的 CRO/CDMO 技术都不断提升,在项目经验、数据分析能力、化合物库的大小、产能规模与利用率都有特定要求,这些都需要时间的积累,企业难以在短时间内同时符合多种要求,因此需通过一系列的并购整合实现高速增长,过往外国企业的并购史将会是国内企业的参照。
20 世纪,多只重磅药面世,对 CRO 的外包服务需求殷切,行业并购活动频繁,现时龙头 Covance 有今天的成就,与它能把握机会进行并购整合有关。Covance 的起源可以追溯到 1968 年,其前身环境科学公司(生产与实验动物有关的设备)在华盛顿州西雅图开业。1972 年,它购买了 Hazleton 实验室并命名为 Hazleton 实验室,这是一家进行毒理学测试的合同实验室。1977 年,康宁玻璃厂购买了 Hazleton 的股份。到 1982 年, Hazleton 已成为美国最大的独立生物测试公司和生命科学实验室,以及全球最大的设备制造商。该公司对药物,化妆品,杀虫剂和工业化学品进行毒理学测试,同时提供了各种行业的新化合物产品的化学分析,测试了基因突变的化学物质,并使用单克隆抗体进行研究。于 1997 年,Covance 正式从 Corning 分拆出来,并于纽交所上市,及后收购了 Berkeley (California) Antibody Company、Virtual Central Labs 等,与各 CRO 企业斗丽争妍。
于 21 世纪,众多外国企业都依靠并购整合,扩大业务版图,一方面沿产业链纵向扩展,例如 2016 年 Quintiles 和 IMS 合并为 IQVIA,与在医疗咨询领域及市场数据方面有领先优势的 IMS 结合,加强了自身的实力;2017 年 INC Research 和 Inventiv Health 合并成 Syneos 都同样起到协同效应;另一方面进行了横向扩展,例如 Quintiles 在中国成立子公司,充分把握了全球机遇。

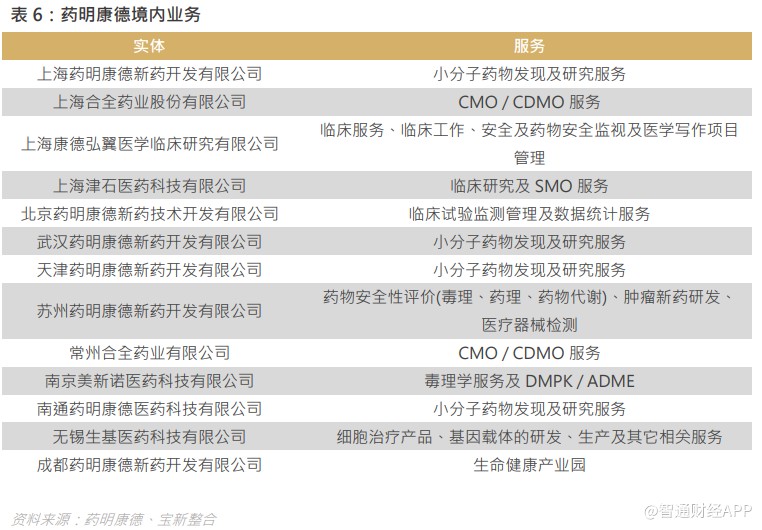
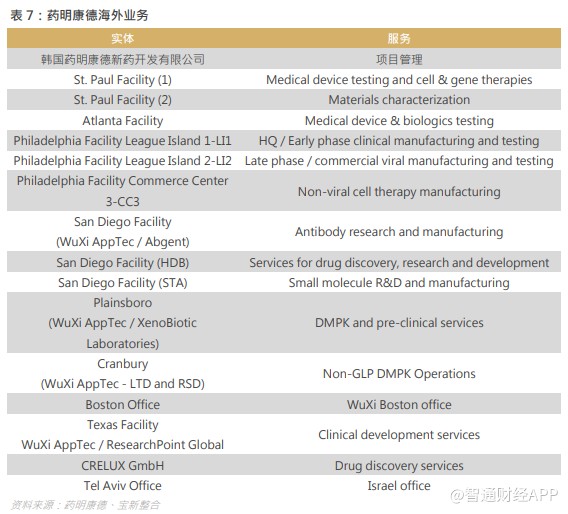
5.3 积极布局大份子
与小份子不同,生物制剂含有的活性物质(产生所需治疗效果的物质)是由生命有机体中生产或提取,它们通常由人体亦会自然产生的蛋白质组成。当生物制剂使用于病人时,它可以像自然蛋白质一样运作,缓解症状及避免或减慢疾病的进展。单抗类药物靶点明确,药效较好且造成的副作用低,因此化学药时代过后,便是生物药时代。除了单抗之外,生物药还包括双抗、疫苗、细胞与基因治疗。进入 21 世纪,单抗为代表的生物药开始加快发展,按 2016 年销售收益计,全球单抗市场占生物制剂市场总额的 42.7%,期后,CAR-T 疗法约在 2015 年跟随着癌症免疫疗法的浪潮而开始被广为注意,象征着细胞/基因治疗的突破。表

除了单抗之外,生物药还包括双抗、疫苗、细胞与基因治疗。进入 21 世纪,单抗为代表的生物药开始加快发展,按 2016 年销售收益计,全球单抗市场占生物制剂市场总额的 42.7%,期后,CAR-T 疗法约在 2015 年跟随着癌症免疫疗法的浪潮而开始被广为注意,象征着细胞/基因治疗的突破。
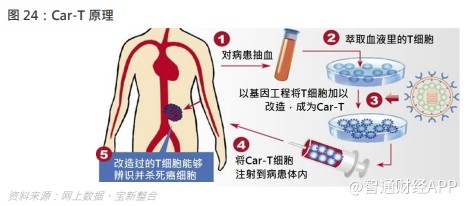
嵌合抗原受体 T 细胞(CAR- T cell)是一种经基因改造的 T 细胞。通过分选出病人体内的 T 细胞,然后以基因工程将 T 细胞改造,成为 CAR- T,这种受体名为「嵌合」是因为它结合了原 T 细胞的功能和新的抗原识别功能于一体。随后将经过修饰的 T 细胞在实验室进行增殖培养并注射到患者体内,利用嵌合抗原受体识别癌细胞,使得对癌细胞的打击和消灭变得更为有效。
在生物药时代,药企都纷纷投放资源于生物药研发。2019 年全球最畅销十大药物名单上,有 7 个是生物药,当中包括艾伯维的 Humira 单抗,默沙东的 Keytruda 单抗。分子的结构愈复杂,开发及生产工艺难度愈大。生物药的结构较小分子药物复杂,主要由蛋白质构成,研发及生产过程易受可变因素影响,研发过程中对于制备抗体具有较高要求,在生产过程中的处理、包装、运输及储存过程都很困难,因为这些原因,生产生物制剂需要一个高水平的技术专长,以及必须非常小心地控制及监控生产过程,以确保最终药品的安全性、疗效及质量。建立生物制剂开发能力及设施(特别是临床与商业化生产设施)乃高度资本密集及费时。例如,生物制剂产品开发商将须提前约三至五年兴建设施以筹备产品审批及推出。
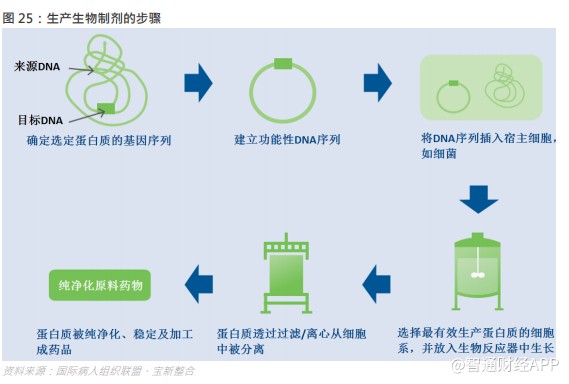
通过委聘生物制剂研发服务供货商,制药及生物技术公司可节省庞大投资金额并加快生物制剂产品的发现、开发及商业化,因此在生物药研发和生产中,CRO/CDMO 企业能够发挥重要作用。例如,药明生物有着一次性生产技术,使用一次性生物反应器的设施其建设周期可缩短 12 到 18 个月,成本减少 30%到 50%,与传统的不锈钢生物反应器相比,可以生产多出 5%到 15%的批次具有更高的生产成功率。另外,凭借强大的技术平台和一体化的服务模式,药明生物可以在最短时间内为客户实现从 DNA 到 IND 相关 CMC 工作,做到降低药物开发成本,减少开支。
总括而言,从小分子到大分子再到细胞与基因疗法,药物研发与生产的难度不断加大, 导致了研发与生产成本的增加,由于医药外包服务行业能提供低成本、高效益的服务,因此在产业链中的地位正在提升。
6. 估值
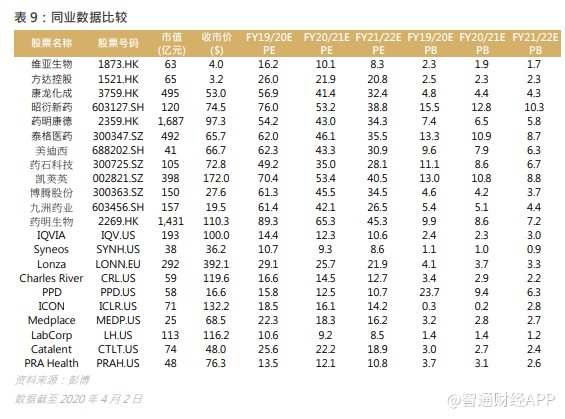
可以看到,国内 CRO/CDMO 的估值普遍比外企高,反映出投资者愿意为正在起飞的行业付出溢价,鉴于行业利好因素不变,相信国内 CRO/CDMO 未来估值仍会维持于较高水平。
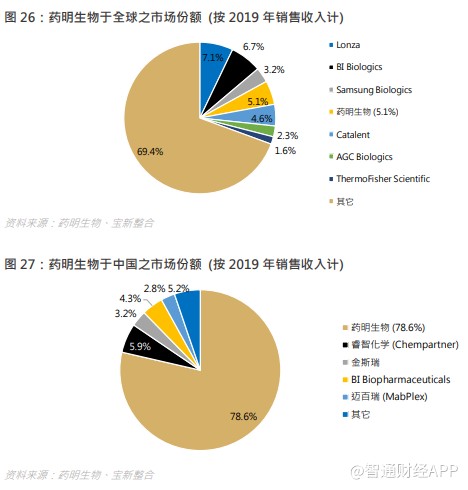
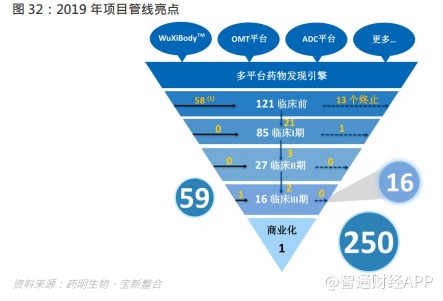
药明生物建立于 2010 年,最初为客户提供细胞系培育和蛋白质分析服务。经过多年积极稳步发展,公司业务扩大到生物新药发现、生物新药开发、生物检测以及 GMP 生产,凭借遍布全球的高标准生产基地和实力强劲的科研团队,药明生物成长为一家真正提供从概念到商业化一站式服务的开放式生物制药技术平台公司。2017 年,药明生物正式在香港交易所上市。截至 2019 年底,在药明生物平台上研发的综合项目达 250 个,包括 121 个处于临床前研究阶段,112 个在临床早期(I 期,II 期)阶段,16 个在后期临床(III 期)以及 1 个在商业化生产阶段。预计到 2022 年,公司在中国、爱尔兰、新加坡、美国规划的生物制药生产基地合计产能将超过 28 万升,这将有力确保公司通过健全强大的全球供应炼网络为客户提供符合全球质量标准的生物药。按照收入计算,药明生物市场份额在全球排第四,中国排第一。
7. 药明生物-大分子 CDMO 龙头
7.1 业务快速增长支持高估值
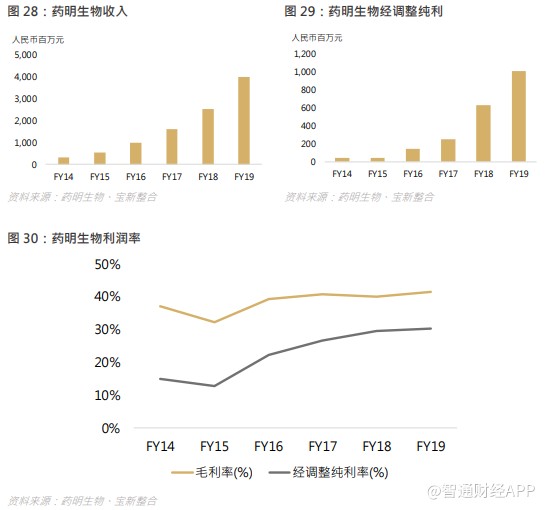
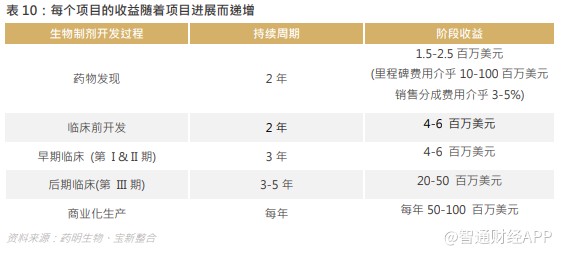
公司营业收入从 2014 年的 3.3 亿元增至 2019 年的 39.8 亿元,经调整纯利从 0.5 亿元增至 2019 年的 12.1 亿元,复合年增长率分别为 64.4%及 89.2%,随着生产规模扩大,以及每个项目的收益随着项目进展而递增,毛利率及净利率均稳步上扬,因此药明生物的长期高估值是受着业务快速增长的支持。
7.2 持续增长的综合项目数
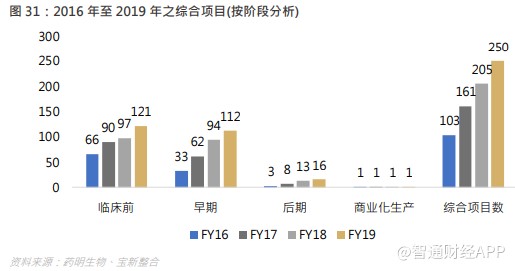
集团综合项目数增长强劲,截至 2019 年底,集团共有 250 个综合项目,对比截至 2018 年底的 205 个,当中有 59 个项目转移至集团。临床前项目数由去年同期的 97 个,增长至 121 个。早期(第 I 及 II 期)临床开发项目数由去年同期的 94 个,增长 19.1%至 112 个(其中 I 期项目 85 个、II 期项目 27 个)。后期(第 III 期)临床开发项目数由去年同期的 13 个,增长 23.1%至 16 个。集团项目从 IND 前阶段转入到 IND 后阶段取得显著进展。于报告期内,21 个项目已由临床前开发阶段进入早期临床开发阶段。
7.3 未完成订单增长强劲,为未来盈利增长带来支持
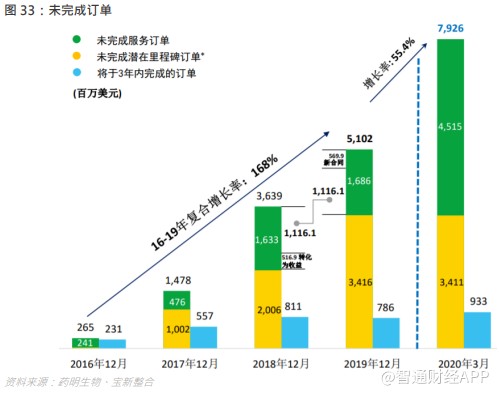
集团未完成订单总量(包括未完成服务订单及未完成潜在里程碑付款)由 2018 年的 36.4 亿美元大幅增长 40.2% 至 2019 年的 51 亿美元,其中未完成服务订单由 16.3 亿美元增长至 16.9 亿美元,而未完成潜在里程碑付款由 20.1 亿美元增长 70.3%至 34.2 亿美元。集团未完成订单持续增长,2016-2019 年复合增长率为 168%,为未来收益增长帶來支持,并显示 Follow- the- Molecule 战略效果显著。
7.4 业务能见度高
在集团“跟随药物分子发展阶段扩大业务”策略下,客户对公司提供服务的需求随着生物制剂开发过程的推进并最终商业化生产而不断增加,并使得公司来自每个项目的综合收益随着项目在生物制剂开发周期中的推进而呈几何级数增加。由于监管的要求、漫长且昂贵的技术转移过程及客户对不间断供应的需要,一旦委聘,客户通常会在整个生物制剂开发过程选用集团的综合服务且不会更换成其他服务供货商。一个项目从一家生物外包提供商到另一家的停顿时间和转换成本通常在 IND 前阶段为 6 个月/ 1-3 百万美元,在 IND 后阶段为两年/ 500 万-5,000 万美元。由于技术转让流程冗长而且昂贵,生物药研发项目粘性较强,锁定早期项目更容易使合作关系延续至商业化生产阶段。
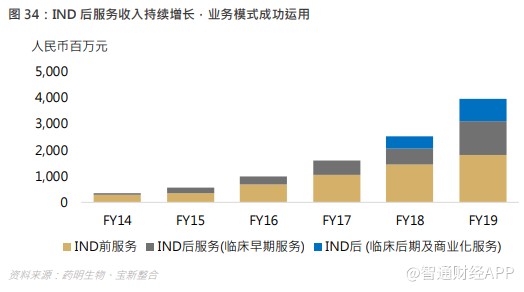
截至 2019 年底,集团的 IND 前服务收益增长 24.6%至约人民币 1,808.4 百万元,占总收益的 45.4%。同时,由于实施“跟随药物分子发展阶段扩大业务”策略,越来越多的项目由 IND 前阶段进入临床早期及临床后期阶段等后续阶段,集团的 IND 后服务收益显示更快速的增长,其增加 98.6%至约人民币 2,152 百万元,占总收益的 54%。
7.5 全球客户日益增长
2019 年,药明生物持续开拓客户,优化客户结构,不仅为全球领先的医药公司及中型生物技术公司提供服务,包括全球前 20 大制药公司的 13 家及中国前 50 大制药公司的 26 家,也持续深耕市场,赋能初创公司及其他小型生物技术公司。相比于 2018 年为 220 家客户服务,集团于 2019 年服务 266 家客户。

随着进入较后阶段的项目数持续增加,加之引入更多客户项目,集团前十大客户中的每名客户平均收益由截至 2018 年的约人民币 119.3 百万元增加 65.6%至 2019 年的约人民币 197.6 百万元。
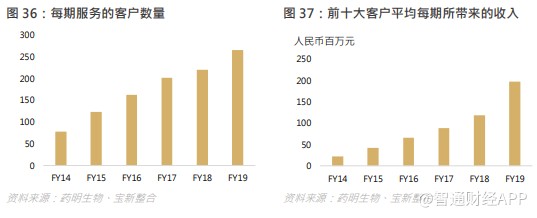
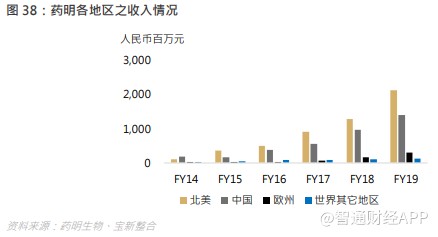
7.6 全球业务快速发展北美、中国和欧洲保持强劲增长,成为三大增长引擎。2019 年,北美、中国和欧洲收入分别为 21.4 亿、14.1 亿和 3.1 亿元,收入占比分别为 53.7%、35.3%、7.8%,同比增速达 66.5%、43.6%、81.4%。
现时,集团持续投资于产能扩张计划,以满足持续增长的全球生物药生产需求,亦有助集团为越来越多的后期项目提供产能,与集团“药明生物提供全球双厂生产”的长期全球化策略保持一致。集团目标是于 2022 年提供总计高达 280,000 升的生物药生产产能,打造覆盖 4 个国家的全球供应炼网络。
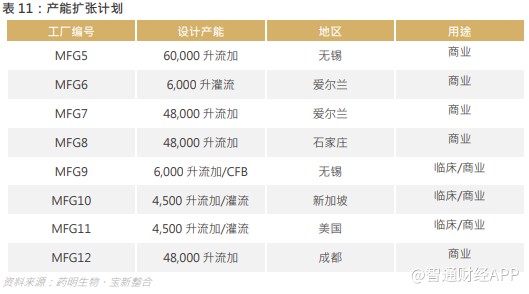
集团的合作伙伴可以从集团位于中国、欧盟及美国的全球供应网络内的基地进行生产,以保证产品的全球供应,并消除在不同供货商间进行技术转移的风险。
7.7 多重增长引擎 助力飞速发展
集团全球领先的抗体偶联药物(ADC)制剂三厂(DP3)于报告期内开始投入 GMP 生产。凭借持续升级的 WuXiBody™双特异抗体平台,集团成为全球为数不多有能力为双特异抗体及抗体偶联药物生物药提供原液及制剂一站式服务的 CDMO 之一。
WuXia 细胞系平台集团拥有自主知识产权的细胞株构建平台 WuXia,每年可开发超过 60 个 IND 项目,为全球最大的细胞系平台之一。WuXia 已提供超过 277 个细胞系用于临床前开发及后期开发。配合具有自主知识产权的表达载体系统,可获得高表达量的前三克隆,并与工艺开发及 cGMP 生产高效整合。搭配 cGMP 细胞库构建及细胞系表征服务,WuXia 平台可以全方位支持包括单抗、双特异性抗体、融合蛋白及重组蛋白等多种治疗性蛋白质的生产。
WuXiUP 连续生产平台集团拥有自主知识产权的连续生产工艺平台 WuXiUP,运用 2,000 升一次性生物反应器达到与 20,000 升传统不锈钢反应器相当的批次产量,同时实现媲美传统纯化工艺甚至更高的纯化收率,因此加速生物药的开发及生产以及提高生物药的可及性。WuXiUP 已广泛应用于超过 17 个项目的单抗、双特异性抗体、融合蛋白及酶,达致超高效生产。

WuXiBody 双抗技术平台
什么是双特异性抗体? 双特异性抗体利用两种抗体的特性并将其结合,同时确认不同抗原或表位,旨在治疗多面向的复杂疾病,并持续展现重大的医疗价值。现有逾 100 种不同的双特异性格式,且有约 80 种双特异性抗体正进行临床测试。双特异性抗体被多人认为是治疗癌症及其他疾病的下一代蛋白质治疗药物。
项目进展及效果
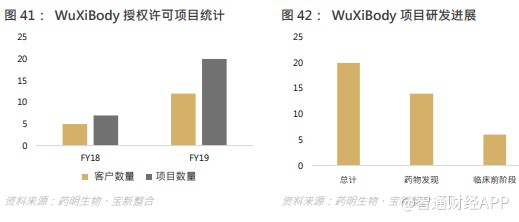
集团研发推出创新的 WuXiBody™双特异性抗体平台,赋能客户更快及更易开发创新双特异性抗体。 WuXiBody™极具灵活性,可轻易通过连接几乎任何一对单抗以构成双特异性抗体。在收到单抗序列后,仅需 2 至 4 个月即可通过 WuXiBody™平台研发生成双特异性抗体。其后,从开发及生产此新双特异性抗体至 IND 仅需 16 至 18 个月,与单抗开发所需时间相若。此外,WuXiBody™还具有多种其他优势,其中包括高产量、易溶性、血清稳定性及延长体内半衰期。于报告期内,集团已与 12 个合作伙伴签署 20 项 WuXiBody™授权协议。与 WuXiBody™相关的业务目前已经成为集团的强劲增长点。
ADC 技术平台
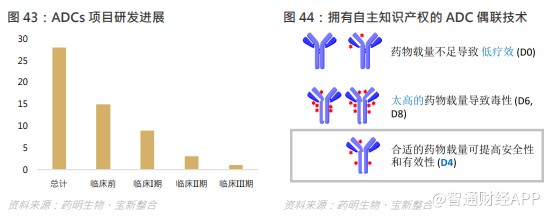
什么是 ADC? ADC 是一种新兴高药效生物药,由抗体通过化学偶联子连接俱生物活性的药物或细胞毒性化合物组成。该等极为复杂的“制导导弹”由抗体携带诸如强力抗癌药等药物,通常为治疗的最后手段。相较于传统化疗及单抗 (mAbs),ADC 功效卓越、对非目标的毒性较低且治疗窗口范围较大,相关研究显示,ADC 能够帮助生存机率不乐观的病人。于 2019 年,14 个获美国 FDA 批准的新生物药中有 3 个为 ADC,为历年最多。ADC 候选药物数量也达到前所未有的水平,业界普遍对 ADC 的时代来临保持乐观。
项目进展及效果
集团在全球 ADC 生物药一站式服务技术平台领域保持领先地位。于报告期内,集团已为客户及合作伙伴开发或正在开发 28 个 ADC,且已成功支持 13 个 ADC 项目推进至 IND 申请阶段。
疫苗 CDMO 业务
集团就疫苗 CDMO 业务与一家全球疫苗巨头订立战略合作伙伴生产供应合同。据此战略合作伙伴生产供应合同,集团附属公司 WuXi Vaccines Ireland Limited“药明海德”将于爱尔兰建设集疫苗原液及制剂生产、质量控制实验室于一体的综合疫苗生产基地,并为集团疫苗合作伙伴生产若干疫苗。合同的初步期限为 20 年,总价值预计超过 30 亿美元。与全球疫苗巨头成为战略合作伙伴,并为全球市埸生产疫苗充分展示集团的技术优势及首屈一指的质量标准。疫苗业务将对集团的未来整体业务增长作出重大贡献。
总体而言,药明生物强大的技术领先地位、持续改进的技术能力、优秀的过往记录及卓越的质量体系推动其在全球及中国获得更多市场份额,集团“跟随药物分子发展阶段扩大”加上“提供全球双厂生产的长期全球化策略”正为生物技术行业带来创新与变革,能加快产品上市,以及降低生产成本。现时集团在北美、欧洲和中国的三大市场都在快速发展,收入及盈利均录高增长,支持着药明生物的高估值。
(编辑:郭璇)



 扫码下载智通APP
扫码下载智通APP