Immutep(IMMP.US)LAG-3疗法显著提高Keytruda缓解率;百时美施贵宝(BMY.US)Opdivo首度获批治疗食管癌
本文来自药明康德。
92%疾病控制率!Mirati组合疗法初露锋芒
Mirati Therapeutics(MRTX.US)公司公布了其在研蛋白激酶抑制剂sitravatinib与抗PD-1抗体nivolumab联用,在1/2期临床试验中治疗晚期肾透明细胞癌(aCCRCC)患者时的初步临床数据。初步疗效数据表明,这一组合疗法在这一患者群中达到92%的疾病控制率。
Mirati公司开发的sitravatinib是一款具有谱系选择性的口服受体酪氨酸激酶(RTK)抑制剂。它能够抑制几种类似的RTKs,包括TAM(Tyro3/Axl/MERTK)、VEGFR2和KIT。而这些RTKs在营造具有免疫抑制功能的肿瘤微环境方面具有重要的作用。
通过抑制这些RTKs,sitravatinib能够起到多种调控免疫系统的作用,包括将具有免疫抑制功能的M2巨噬细胞转化M1巨噬细胞,扩展CD8阳性T细胞数目,降低具有免疫抑制能力的调节性T细胞(Treg)和髓源抑制细胞(MDSCs)细胞的数目,从而克服对检查点抑制剂的耐药性。
在这项1/2期临床试验中,截至2020年1月1日,38名患者接受治疗超过12周,并且可以被评估。这些患者曾经接受过靶向VEGF的靶向疗法,但是疾病继续进展。初步试验结果表明:
15/38(39%)的患者获得确认的部分缓解(PR),其中一名PR患者进一步改善至未确认的完全缓解(CR)
35/38(92%)的患者疾病得到控制(疾病稳定+PR+CR)
初步中位无进展生存期(PFS)为10.3个月
中位总生存期(OS)尚未达到(中位随访期为17.7个月),截至今年1月1日,79%的患者仍然在接受治疗。
1/2期临床试验的初步疗效结果表明,与nivolumab单药相比,sitravatinib组合疗法表现出令人鼓舞的持久缓解。
靶向小细胞肺癌!创新口服疗法斩获FDA优先审评资格
PharmaMar和Jazz Pharmaceuticals公司联合宣布,美国FDA接受了lurbinectedin的新药申请(NDA)。这一申请基于2期临床试验结果,寻求FDA加速批准,治疗小细胞肺癌(SCLC)患者,这些患者在接受铂基疗法后疾病继续进展。FDA同时授予这一申请优先审评资格,预计在今年8月16日之前做出回复。
Lurbinectedin是一种RNA聚合酶II的抑制剂。它不但能够抑制肿瘤细胞的致癌转录过程,而且可以通过抑制肿瘤相关巨噬细胞的致癌转录过程,降低促进肿瘤生长的细胞因子的生成。
去年12月,Jazz Pharmaceuticals公司与PharmaMar达成数额为10亿美元的合作,获得lurbinectedin的开发和推广权益。而中国的绿叶制药集团也在去年与PharmaMar达成合作,获得lurbinectedin在中国的开发及推广权益。
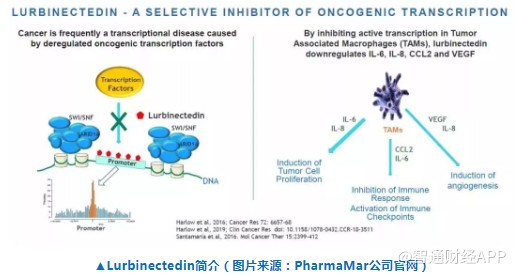
这一申请是基于一项多中心2期临床试验结果。总计105名患者参与了这一临床试验。试验结果表明,lurbinectedin作为单药疗法,在治疗经治SCLC患者时,达到35.2%的客观缓解率(ORR)和68.6%的疾病控制率(DCR)。患者中位缓解持续时间达到5.3个月。在8名曾经接受过癌症免疫疗法治疗的患者中,5位产生响应。
长期疗效喜人!BMS重磅免疫疗法造福晚期肾癌患者
百时美施贵宝(BMY.US)公司宣布,其免疫疗法Opdivo(nivolumab)与Yervoy(ipilimumab)联合,在治疗未接受过治疗的晚期或转移性肾细胞癌(RCC)患者的3期临床试验CheckMate-214中,显示出良好的长期疗效,50%的患者在随访42个月时依然存活。
BMS带来的Opdivo是世界上首个获得批准的PD-1免疫检查点抑制剂。该药物目前已在包括美国、欧盟和日本的60多个国家获得批准。2015年10月,Opdivo和Yervoy联合用药方案成为首个获得批准治疗转移性黑色素瘤的联合免疫疗法。该联合疗法目前已获得包括美国和欧盟在内的50多个国家的批准。
CheckMate-214研究的最新结果显示,50%接受Opdivo和Yervoy联合治疗的患者在随访42个月时依然存活,而接受当前标准疗法舒尼替尼(sunitinib)治疗的患者中仅有39%存活,该组合疗法显示出显著的总生存期(OS)益处。根据独立评审委员会的评估,超过80%使用该联合疗法治疗的患者的疾病缓解得以维持,并仍在持续缓解中。其中,分别有84%和86%的中低风险(IP)和意向治疗(ITT)患者的疾病仍在持续缓解中。
此外,值得一提的是,Opdivo单药在治疗晚期或转移性经治RCC患者的CheckMate-025试验中也显示出良好的长期疗效。在随访64个月时,26%接受Opdivo单药治疗的患者仍然存活,表现出显著的OS获益。而接受everolimus治疗的患者中依然存活的仅为18%。Opdivo治疗组中患者的客观缓解率(ORR)为23%,活性对照组中的这一比例为4%。与活性对照组相比,Opdivo的中位缓解持续时间(mDOR)更长,分别为18.2个月和14个月。
显著提高Keytruda缓解率!LAG-3疗法临床表现亮眼
Immutep(IMMP.US)公司宣布,该公司的可溶性LAG-3融合蛋白eftilagimod alpha(efti,又名IMP321),与默沙东(MRK.US)公司的重磅PD-1抑制剂Keytruda联用,在2期临床试验中获得积极中期结果。在一线治疗非小细胞肺癌(NSCLC)患者时,这一组合疗法达到47%的总缓解率(ORR)。而如果不筛选PD-L1表达水平高的患者,Keytruda单药疗法治疗NSCLC患者的缓解率只有20%。同时,这一组合疗法二线治疗头颈部鳞细胞癌(HNSCC)患者时也达到33%的ORR。
Keytruda虽然已经获批治疗NSCLC患者,然而PD-L1的表达水平对患者能否从这一疗法中获益产生很大影响。据统计,PD-L1表达>50%的NSCLC患者,接受Keytruda单药治疗的缓解率接近40%,而PD-L1表达水平在1%-49%的患者的缓解率只有15%-20%,不表达PD-L1的患者预计响应更低。如何扩展从Keytruda疗法中获益的患者群是默沙东公司研究的重点之一。可溶性LAG-3蛋白有可能通过激活免疫细胞的反应,增强Keytruda的疗效。
Eftilagimod alpha在名为TACTI-002的2期临床试验中,与PD-1抑制剂Keytruda联用,治疗不同类型的NSCLC患者,以及头颈部鳞细胞癌患者。试验第一部分队列A组患者为从未接受过PD-1/PD-L1抑制剂治疗的NSCLC患者。参加试验的患者无需考虑其PD-L1表达水平。试验结果表明,在17名接受治疗的患者中,ORR达到47%。而且PD-L1表达水平不同的三类患者中都有患者出现缓解,8名出现缓解的患者中5名PD-L1表达水平<50%。
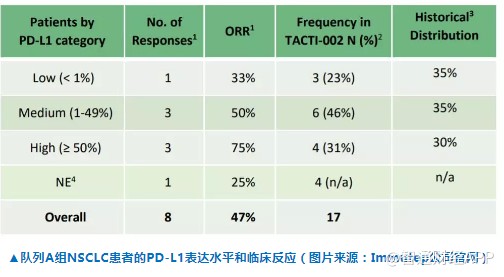
基于TACTI-002的积极临床结果,Immutep公司已经启动该临床试验的第二阶段,招募更多患者检验这一组合疗法的效果。
特应性皮炎患者福音!Incyte外用JAK抑制剂达到3期临床终点
Incyte公司宣布,其JAK抑制剂ruxolitinib的外用配方,在治疗特应性皮炎患者的第二项3期临床试验TRuE-AD1中达到主要研究终点。
Ruxolitinib乳膏是一种创新外用Janus激酶1和2(JAK1/JAK2)抑制剂,可降低口服JAK抑制剂的全身性副作用。JAKs属于细胞质酪氨酸激酶家族,其功能是转导细胞因子(如干扰素)介导的信号。
Ruxolitinib在治疗轻度至中度青少年和成人特应性皮炎患者的3期临床试验TRuE-AD1中,治疗8周后,与对照组相比,使50%(剂量为0.75%)和53.8%(剂量为1.5%)患者的研究者总体评估总分(IGA)较基线时达到2分以上的显著改善,而安慰剂组中达到这一标准的患者只有15.1%,达到该试验的主要研究终点。
此前,ruxolitinib在治疗轻度至中度青少年和成人特应性皮炎患者的3期临床试验TRuE-AD2中也达到该试验的主要研究终点。另外,在两项试验中,与对照组相比,接受两种剂量ruxolitinib治疗的患者中均观察到由瘙痒数字评定量表(NRS4)测量的止痒效果。
有望8月获批!血友病基因疗法喜获FDA优先审评资格
BioMarin Pharmaceutical(BMRN.US)公司宣布,美国FDA接受了该公司为治疗A型血友病的基因疗法valoctocogene roxaparvovec递交的生物制品许可申请(BLA)。FDA同时授予这一申请优先审评资格,预计在今年8月21日前做出回复。如果获批,这将是美国批准的治疗血友病的首款基因疗法。
Valoctocogene roxaparvovec是一种使用AAV5病毒载体递送表达因子VIII的转基因的基因疗法。它的优势在于患者可能只需要接受一次治疗,肝细胞就可以持续表达因子VIII,从而不再需要长期接受预防性凝血因子注射。该疗法已经获得美国FDA授予的突破性疗法认定和欧盟授予的PRIME药品认定,以及EMA和FDA授予的孤儿药资格。
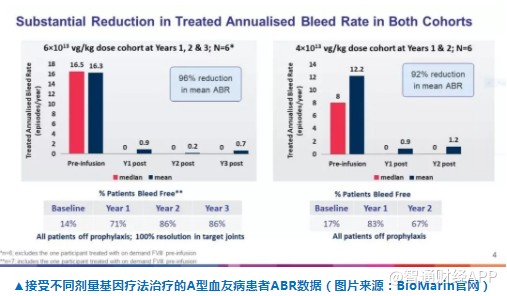
这一申请是基于正在进行的3期临床试验的中期数据分析,以及1/2期临床试验的最新3年疗效数据。在国际血栓和止血学会2019年会(ISTH2019)上公布的最新数据显示,在1/2期临床试验中接受一次剂量为6e13 vg/kg的基因疗法治疗的患者,在接受治疗后第三年,年出血率(ABR)和使用因子VIII的需求继续得到控制。在接受治疗的3年过程中,ABR和因子VIII使用率都平均下降96%。患者不再需要预防性因子VIII注射。
全球首批!百时美施贵宝Opdivo首次获批治疗食管癌
百时美施贵宝(BMS)公司宣布,日本厚生劳动省(MHLW)已批准其PD-1抑制剂Opdivo(nivolumab)治疗无法切除的晚期/复发性食管癌患者,这些患者在化疗后疾病依然进展。这是Opdivo首次获批用于治疗晚期食管癌患者,也是首款在日本被批准治疗食管癌患者的癌症免疫疗法。
Opdivo是一种PD-1免疫检查点抑制剂,旨在帮助恢复抗肿瘤免疫反应。通过利用身体自身的免疫系统对抗癌症,Opdivo已成为多种癌症的重要治疗方法。2014年7月,Opdivo成为世界上第一款获得批准的PD-1免疫检查点抑制剂。目前,该疗法在中国大陆获批用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
该批准是基于一项名为ATTRACTION-3的3期临床研究的结果,该研究旨在评估Opdivo对比化疗(多西他赛或紫杉醇),治疗对氟嘧啶和含铂药物联合疗法不耐受的,无法切除性晚期或复发性食管鳞状细胞癌(ESCC)患者的疗效与安全性。试验结果显示,与化疗相比,Opdivo在主要终点总生存期(OS)上表现出具有统计学意义的显著获益,将患者的死亡风险降低了23%,并将患者的中位生存期延长了2.5个月。
(编辑:郭璇)



 扫码下载智通APP
扫码下载智通APP