2019年创新药获批最大赢家:诺华(NVS.US)
本文源自微信公众号“医药魔方”,作者为青瓦。
截止到12月28日,美国FDA共批准了48款新药(包括新分子实体和新生物制品),相比2018年的59款略有下降;欧盟EMA共批准了37款新药(包括新活性物质,不包括仿制药、生物类似物) ,低于2018年的64款;中国NMPA共批准了48款新药(包括化药1类和5.1类,生物制品1类和2类、中药和疫苗),略低于2018年的53款。
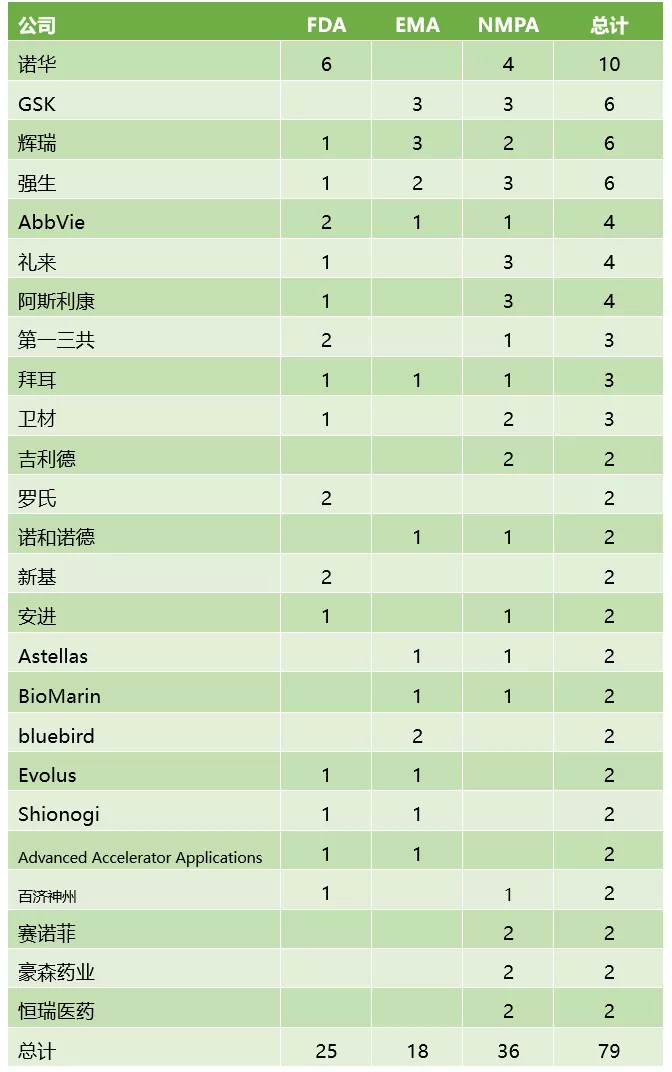
本文将每个监管机构的批准单独计数统计,从企业维度统计了2019年获批新药数量最多的20家企业。结果显示,诺华(NVS.US)是2019年创新药获批的最大赢家,共收获了10项批准。其次是GSK(GSK.US)、辉瑞(PFE.US)、强生(JNJ.US),均有6项新药批准。礼来(LLY.US)、艾伯维和阿斯利康(AZN.US)各有4项,第一三共、拜耳和卫材各有3项,这10家企业2019年在欧美中法规市场新药获批数量居榜单TOP10。
2019年获批创新药数量最多的企业
下面对前10家企业获批的新药做一介绍。
NO.1 诺华
诺华在2018年仅从FDA收获1款新药,今年则迎来大丰收,从FDA摘下6款新药,居FDA批准榜单首位。包括:
治疗6岁以上的片形吸虫病患者的Egaten(triclabendazole);
治疗成人复发型多发性硬化症的Mayzent(siponimod);
联合氟维司群用于接受过内分泌疗法后疾病进展的HR+、HER2-的PI3Kα突变绝经后女性乳腺癌患者的Piqray(alpelisib);
用于治疗两个编码运动神经元生存蛋白(SMN)的SMN1等位基因上携带突变的2岁以下脊髓性肌肉萎缩症(SMA)患者的基因疗法产品Zolgensma(onasemnogene abeparvovac-xioi);
湿性年龄相关性黄斑变性的单克隆抗体Beovu(brolucizumab);
用于在16岁以上镰状细胞贫血症患者中降低血管阻塞危机发生频率的单抗Adakveo(crizanlizumab-tmca)
诺华2019年获批新药

来源:医药魔方
除了在FDA拔得头筹,诺华2019年在中国获批的新药也是首屈一指。包括治疗银屑病的IL-17A单抗药物司库奇尤单抗注射液,治疗多发性硬化症的盐酸芬戈莫德胶囊,以及治疗BRAF V600突变阳性的不可切除或转移性黑色素瘤的甲磺酸达拉非替尼胶囊和曲美替尼片。
事实上,诺华2019年在中国不仅收获了最多的新品种,也是医保谈判的最大赢家,沙库巴曲缬沙坦钠片、注射用奥马珠单抗、雷珠单抗注射液等7个品种通过谈判进入国家医保,艾曲泊帕乙醇胺片、利斯的明透皮贴剂、二甲双胍维格列汀片、0.5%盐酸莫西沙星滴眼液4个通过常规准入进入医保目录。
诺华全球药物开发负责人兼首席医疗官John Tsai博士也曾在公开场合表示,鉴于NMPA已经加快新药审评审批速度,诺华计划在2023年前在中国提交50个新药申请(NDAs)。
在12月5日的“诺华R&D Day”上,诺华生物医学研究中心(NIBR)总裁Jay Bradner博士称NIBR是诺华公司重要的内部研发引擎,拥有约5600名科学家,340个开发项目,90多个在研新分子实体(NME)。NIBR的研发重点之一是开发新一代治疗模式的技术平台,这包括细胞疗法,基因疗法,分子胶(molecular glues),放射性配体疗法等新兴技术平台。
此前,Evaluate Pharma报告曾预测:诺华将在2024年超越辉瑞和罗氏,以532亿美元的营收成为全球最大的处方药企业。按照这个新药申请和获批节奏,诺华重返行业老大指日可待。
NO.2 GSK
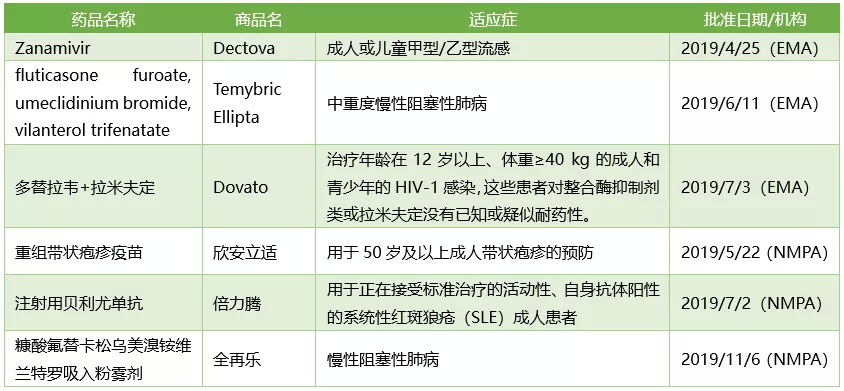
2019年GSK 并未从美国FDA收获新产品,不过欧洲EMA和中国NMPA各批准了其3款新药的上市。
葛兰素史克2019年获批新药
来源:医药魔方
GSK当前的优势业务集中在呼吸疾病、艾滋病和疫苗三大领域。令人遗憾的是,FDA近日在完整答复函中拒绝批准了GSK旗下控股公司ViiV Healthcare开发的HIV长效组方注射剂Cabenuva(CAB/RPV),原因是“与化学生产和控制(CMC)”有关。
NO.3 辉瑞
辉瑞2018年从FDA收获了4款新药,但是2019年只有1款。好消息是EMA和NMPA为其带来了好消息,使得其年度批准新药达到了6项。
辉瑞 2019年获批新药

来源:医药魔方
NO.4 强生
今年4月,FDA批准强生旗下杨森公司的Balversa(erdafitinib)用于治疗局部晚期或转移性膀胱癌成人患者。Balversa曾被授予突破性疗法认定,同时获批的还有Qiagen开发的一款伴随诊断器械,用于检测FGFR2和FGFR3的突变。该器械将被用于选择具有FGFR2和FGFR3突变的患者,从而接受Balversa治疗。
强生2019年获批新药

来源:医药魔方
此外,强生还在欧盟摘下2款新药市场营销权:治疗成人男性非转移性去势抵抗前列腺癌的Erleada(apalutamide)和治疗重度抑郁症的Spravato(esketamine)。强生在中国获批的3款新药分别是多发性骨髓瘤药物兆珂(达雷妥尤单抗注射液)、去势抵抗前列腺癌安森珂(阿帕他胺片)、治疗中重度斑块状银屑病的特诺雅(古塞奇尤单抗注射液)。其中,达雷妥尤单抗是全球首个抗CD38单抗药物,古塞奇尤单抗曾被列入国家第一批临床急需境外新药名单目录。
NO.5 艾伯维
今年6月,艾伯维和艾尔建宣布两家公司已签订最终交易协议,艾伯维将按照协议以现金和股票交易的形式收购艾尔建,交易金额高达630亿美元。
艾伯维2019年获批新药

来源:医药魔方
艾伯维2019年从FDA共拿下2款新药,分别是治疗斑块状银屑病的Skyrizi(risankizumab-rzaa)和治疗对氨甲喋呤(MTX)响应不足或者不耐受的中重度类风湿关节炎患者的Rinvoq(upadacitinib)。其中Skyrizi(risankizumab-rzaa)在FDA批准后的2天也获得了EMA的批准。艾伯维的基因1~6型丙肝感染的DAA药物艾诺全 (格卡瑞韦哌仑他韦片)于今年5月获得中国NMPA批准上市。
12月23日,艾尔建宣布FDA批准Ubrelvy(ubrogepant)的上市申请,用于成人偏头痛患者的急性救治,这也是FDA批准的首个口服小分子降钙素基因相关肽(CGRP)受体拮抗剂。因艾伯维和艾尔建的交易尚未尘埃落定,故这款新药未归在艾伯维名下。
NO.6 礼来
与其他跨国药企扎堆布局肿瘤药物有所不同,礼来选择了在糖尿病、自身免疫疾病、偏头痛这几个领域深耕。2019年,礼来共有3款新药在中国获批,这一数量仅次于诺华,与GSK、阿斯利康相同。
礼来2019年获批新药

来源:医药魔方
今年10月,FDA批准了礼来偏头痛药物Reyvow(lasmiditan)上市,这款新药最早由礼来开发,中途以100万美元授权给生物技术公司CoLucid,最后被礼来以9.6亿美元再次收回,书写了新药开发领域“弃子”变“王子”的故事。
NO.7 阿斯利康
今年4月,阿斯利康斥资69亿美元从第一三共引进抗体偶联药物trastuzumab deruxtecan(DS-8201)在全球(日本除外)的开发和商业化权益。让人惊喜的是,短短8个月后,这款产品便获得FDA的加速批准,用于治疗既往已接受2种以上HER2靶向疗法的成人不可手术切除或转移性HER2阳性乳腺癌患者。
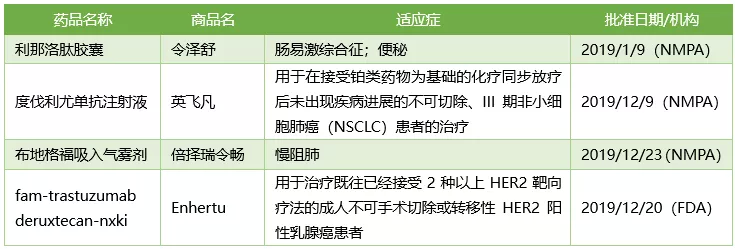
阿斯利康2019年获批新药
来源:医药魔方
阿斯利康2019年共在中国上市了3款新药,分别是治疗肠易激综合征和便秘的令泽舒(利那洛肽胶囊);用于在接受铂类药物为基础的化疗同步放疗后未出现疾病进展的不可切除、III期非小细胞肺癌(NSCLC)患者的治疗药物英飞凡(度伐利尤单抗注射液);治疗慢阻肺(COPD)的药物倍择瑞令畅(布地格福吸入气雾剂)。
除此之外,阿斯利康的肿瘤重磅药物在中国的适应症进一步扩大:奥希替尼获批用于一线治疗EGFR突变阳性局部晚期或转移性非小细胞肺癌(NSCLC)成人患者;PARP抑制剂奥拉帕利获批用于BRCA突变晚期卵巢癌患者的一线维持治疗。
NO.8 第一三共
西他沙星是一种广谱喹诺酮类抗菌药,最早在2008年1月25日即在日本获批上市,用于治疗社区获得性肺炎和尿路感染。西他沙星尚未在美国获批上市,在中国的获批历程也比较漫长,从2014年8月递交上市申请至获批,历时1629天。
第一三共2019年获批新药

来源:医药魔方
Turalio(pexidartinib)是第一三共开发的集落刺激因子1受体(CSF1R)抑制剂,FDA于今年8月批准其用于治疗症状性腱鞘巨细胞瘤(TGCT)成人患者。这些患者的疾病造成严重功能性限制,而且无法通过手术改善疾病症状。值得一提的是,pexidartinib是治疗TGCT的第一个也是唯一的获批疗法。
NO.9 拜耳
拜耳2019年在欧、美、中各收获一款新药。磷酸泰地唑胺片/注射用磷酸泰地唑胺是一种噁唑烷酮类抗生素,最早由韩国Dong-A 制药开发,辗转后授权Trius,Cubist (Merck & Co)和拜耳进行商业化开发。2014年6月在美国上市,2015年6月在欧盟上市,2019年3月获得中国NMPA批准,用于敏感细菌引起的成人急性细菌性皮肤和皮肤结构感染。
拜耳2019年获批新药

来源:医药魔方
7月30日,FDA批准拜耳的Nubeqa(darolutamide)上市,治疗非转移性去势抵抗性前列腺癌(nmCRPC)患者。Darolutamide是一款雄激素受体拮抗剂,曾在今年4月获得FDA授予的优先审评资格。这一批准比FDA的目标行动日提前了3个月。
Vitrakvi(larotrectinib)于2018年11月被FDA加速批准上市,用于治疗携带NTRK基因融合的成年和儿童局部晚期或转移性实体瘤患者,不需考虑癌症的发生区域。larotrectinib是一个针对的是NTRK1、NTRK2或者NTRK3基因融合的靶向药,最早由Loxo Oncology公司研发,拜耳在2017年12月以预付 4亿美元获得larotrectinib的商业化权益。
2019年9月,larotrectinib获得欧盟批准,是欧盟首个批准的不区分肿瘤类型用于治疗具有NTRK基因融合的抗癌药物,用于治疗局部晚期、远端转移、无法手术切除或手术疗效欠佳的且无满意替代治疗方案的神经营养性受体酪氨酸激酶(NTRK)基因融合的成人和儿童实体瘤患者。
NO.10 卫材
艾立布林是一种合成的大田软海绵素(halichondrin B)类似物,作为一种微管蛋白聚合抑制剂,具有新颖的作用机制。中国NMPA于2019年7月批准了甲磺酸艾立布林注射液上市,用于治疗既往接受过至少两种化疗方案(包括蒽环类和紫杉类)治疗的局部复发或转移性乳腺癌患者。
卫材2019年获批新药

来源:医药魔方
吡仑帕奈是一种高选择性、非竞争性的AMPA型受体拮抗剂,也是一种创新性抗癫痫药物,用于成人和12岁及以上儿童癫痫部分性发作患者(伴有或不伴有继发性全面性癫痫发作)的加用治疗。吡仑帕奈片是卫材的4款主力产品之一,于2012年上市,2019年9月获得NMPA批准上市。
12月23日,FDA批准卫材研发的一款orexin受体拮抗剂Dayvigo(lemborexant)上市,用于治疗入睡困难和/或睡眠维持困难的失眠症成人患者(见:有效改善失眠!卫材新药获FDA批准上市)。
上述3款药物的获批,也使得卫材成为了欧、美、中三大法规市场2019年获批新药数量居榜单第10位的企业。
结语
从FDA新药审评审批数量来看,2018年末至2019年初,美国政府的数次停摆确实对FDA的新药审批工作带来了一定程度的影响。以及FDA前任局长Scott Gottlieb辞职或多或少影响了审批效率,因为他任职期间一直致力于推动创新并提高监管效率。
一般情况下,多数新药选择提交EMA上市申请的数据晚于FDA。EMA的人用药品委员会(CHMP)的成员来自欧盟各国,批准程序相对更为复杂,2019年EMA批准新药创下近5年批准新低,或许与英国忙着脱欧,EMA总部影响其工作效率有关。
2019年中国NMPA累计批准了48款新药,跨国药企仍然是最大的赢家,其中仅有11款新药来自国内药企,分别是豪森药业的甲磺酸氟马替尼片和甲磺酸氟马替尼片;恒瑞的注射用卡瑞利珠单抗和注射用甲苯磺酸瑞马唑仑;再鼎医药(ZLAB.US)的甲苯磺酸尼拉帕利胶囊;百济神州(BGNE.US)的替雷利珠单抗注射液;沈阳同联集团的可利霉素片;金迪克生物的四价流感病毒裂解疫苗;天士力的芍麻止痉颗粒;绿谷医药的甘露特钠胶囊和天济药业的本维莫德乳膏。
(编辑:唐梦婕)



 扫码下载智通APP
扫码下载智通APP