2019上半年FDA批准的新药:诺华(NVS.US)旗下居多
本文来自微信公众号“医药魔方”。
2019年上半年FDA共批准了14个新药,包括8个新分子实体、5个新生物制品和1个基因疗法。
1.prabotulinumtoxinA
商品名:Jeuveau
公司:Evolus
2月1日,FDA批准Evolus公司开发的Jeuveau(prabotulinumtoxinA)上市用于治疗成人眉间纹(又称皱眉纹)。
去年5月,该产品被FDA拒绝,理由是与化学、制造和控制(CMC)过程相关的项目存在缺陷。Evolus在去年8月重新提交了Jeuveau的生物制品许可申请,并在今年2月获得FDA批准。
眉间纹是一种常见的面部表情纹,出现在双眉之间,呈现为“川”字形,并且会随着年龄的增长而进一步加深,给人带来一种忧愁、衰老的感觉。在整形医学界,眉间纹的主要治疗方法包括除皱术、激光治疗、注射填充法。其中注射填充法就是采用注射肉毒杆菌或玻尿酸等药物,暂时性地去除皱纹,并使表皮变得光滑紧致,恢复自然的感觉。
2.caplacizumab-yhdp
商品名:Cablivi
公司:Ablynx公司
2月6日,FDA批准赛诺菲旗下Ablynx公司开发的Cablivi(caplacizumab-yhdp)上市,用于治疗获得性血栓性血小板减少性紫癜(aTTP)成人患者,这也是美国批准的首款专门治疗aTTP的疗法。
aTTP是一种危及生命的免疫性凝血障碍。患者的主要特征为在全身小血管中出现大规模凝血,导致严重血小板减少症,微血管病性溶血性贫血,组织缺血和广泛器官损伤,尤其是大脑和心脏。目前标准疗法为每日进行血浆置换(PEX)和使用免疫抑制疗法。然而即便接受标准疗法的治疗,aTTP发作仍然与高达20%的死亡率相关,大多数死亡出现在患者确诊后30天内。
Caplacizumab是一种二价抗血管性血友病因子(vWF)的纳米抗体,后者是一种只含有一个蛋白域的抗体片段,源于骆驼类动物体内只含有重链的抗体。其由两个相同的人源化构建块组成,通过三丙氨酸接头连接。Caplacizumab-yhdp通过重组DNA技术在大肠杆菌中产生,并且具有约28kDa的分子量。这种单蛋白域抗体片段不但具有与抗原结合的能力,而且具有分子量低,稳定性高等优势。
3.triclabendazole
商品名:Egaten
公司:诺华
2月13日,诺华宣布FDA批准Egaten(triclabendazole,三氯苯达唑) 上市,用于治疗6岁以上片形血吸虫病患者。该产品是FDA批准的首个针对这种疾病的治疗药物,也是WHO当前推荐的唯一一个片形血吸虫病治疗药物,并被列入WHO的基本药物清单。
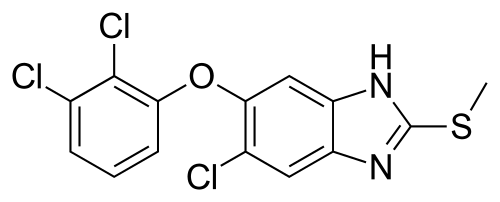
片形吸虫病又称为肝吸虫感染,是一种被忽视的热带疾病。全世界有大约240万患者,另有1.8亿人口有风险患病。它是由两种寄生扁形虫造成,当人们食用受到幼虫污染的食物时,这些寄生虫就可能进入体内。如果不加以治疗,片形吸虫病可导致严重疼痛和不适,导致生活质量和生产能力下降。
WHO在片形吸虫病爆发时会提供这款药物,并且在片形吸虫病流行国家定期使用这种药物。FDA对Egaten的批准将会促进这款药物被进口到这些疾病流行国家,从而确保足够的药物库存。片形吸虫病被FDA定为被忽视的热带病,这一批准为诺华带来一张优先审评券(priorityreview voucher)。
4 .brexanolone
商品名:Zulress
公司:SageTherapeutics
3月19日,FDA批准了Sage Therapeutics用于治疗产后抑郁症的新药Zulress(brexanolone)。该款药物可在注射的60h后显著改善患者的抑郁量表评分,是FDA批准的首个针对产后抑郁的新药。
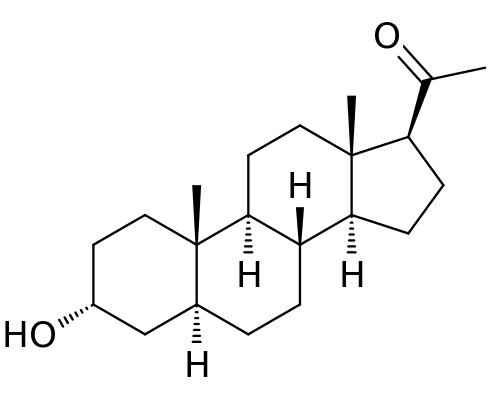
PPD是一种明显且容易识别的严重抑郁症,通常在妊娠晚期或分娩后4周内开始发生,是孕产妇产后自杀的首要原因,也是分娩最常见的医学并发症。主要临床表现包括明显的功能障碍、抑郁情绪、丧失对新生儿的兴趣,同时还伴随相关的抑郁症症状,如食欲不振、睡眠障碍、注意力不集中、无精打采、自尊心不足、自杀倾向。
Brexanolone是一种GABAA 受体的变构调节剂。GABAA受体和NMDA受体分别起到抑制和刺激大脑神经元产生神经冲动的作用。这两种受体活性之间的失衡是包括抑郁症在内的多种精神疾病的原因。
5.solriamfetol
商品名:Sunosi
公司:Jazz制药
3月20日,FDA批准了Jazz制药的Sunosi(solriamfetol),用于治疗发作性睡病(narcolepsy)或阻塞性睡眠呼吸暂停(OSA)综合征相关的白天过度嗜睡。
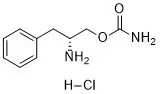
solriamfetol是一种选择性多巴胺和去甲肾上腺素再摄取抑制剂(DNRI)。Jazz制药公司从AerialBioPharma公司获得了solriamfetol除亚洲部分地区之外的全球开发和商业化权利。SK生物制药公司是该化合物的发现者,该公司拥有solriamfetol在韩国、中国、日本在内的12个亚洲国家市场的权利。在美国,solriamfetol还被FDA授予治疗发作性睡病的孤儿药资格。
6.siponimod
商品名:Mayzent
公司:诺华
3月26日,FDA批准诺华公司的新型口服新药Mayzent(siponimod)片剂上市,用于治疗成人多发性硬化症。
多发性硬化症(MS)是中枢神经系统的慢性炎症性自身免疫疾病,其破坏大脑与身体其他部分之间的通信,是成人中神经残疾的最常见原因之一,多发病于青、中年,女性较男性多见。成人MS主要有3种类型:复发缓解型多发性硬化症(RRMS)、继发性进展型多发性硬化症(SPMS)、原发进展型多发性硬化症(PPMS)。RRMS是最常见类型的MS,约占所有MS病例的85%。
SPMS是MS的一种严重病程类型,治疗效果差,预后不佳,疾病修饰疗法一般无效。SPMS通常由RRMS在几次复发后逐渐发展形成,无明显缓解。据估计,大约有25%的RRMS患者在最初确诊的10年内会发展为SPMS,症状逐渐恶化,伴随神经功能渐进性退化和残疾累积,治疗方法十分有限。
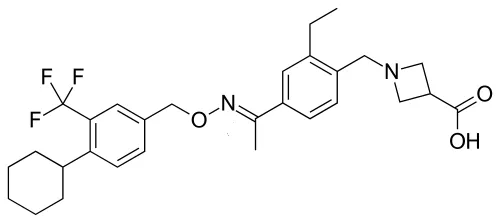
Siponimod是鞘氨醇-1-磷酸受体(S1PR)的选择性调节剂,是Gilenya(芬戈莫德)的升级产品。Gilenya最早在2010/9/21获批,用于成人复发型MS患者,是首个用于降低MS患者复发频率的口服疗法。2018/5/11,Gilenya还被扩大用于10岁以上儿童和青少年MS患者,成为首个治疗儿童MS的药物。Gilenya的2018年全球销售额创下了33.41亿美元的历史新高,不过在2018年底遭遇了FDA的安全警告。
7.romosozumab-aqqg
商品名:Evenity
公司:安进/优时比
4月9日,FDA批准安进/优时比共同开发的Evenity(romosozumab-aqqg)上市,治疗绝经后妇女骨质疏松症。这些患者发生过骨质疏松导致的骨折或者骨折风险较高,或者对其他骨质疏松疗法无响应或不耐受。
Evenity是一种全人源化单克隆抗体,通过抑制骨硬化蛋白(sclerostin)活性发挥作用,该药具有双重作用,它既能增加骨骼形成,又能在较小程度上减少骨吸收(或骨质流失),从而降低骨折风险。
8.erdafitinib
商品名:Balversa
公司:杨森
4月12日,FDA批准杨森Balversa(erdafitinib)上市,治疗含铂疗法化疗后疾病进展的FGFR3或FGFR2突变的局部晚期或转移性膀胱癌。
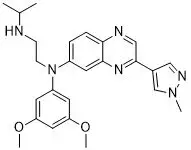
Balversa是一种口服泛FGFR抑制剂。FGFRs是一个受体酪氨酸激酶家族,在不同肿瘤中出现的基因突变可以导致它们被激活,从而促进肿瘤细胞的生存和增殖。另外,Balversa也是FDA批准的首款针对转移性膀胱癌的靶向疗法。
9.risankizumab-rzaa
商品名:Skyrizi
公司:艾伯维
4月23日, FDA批准艾伯维IL-23抑制剂Skyrizi(risankizumab-rzaa)上市,治疗符合系统治疗或光疗指征的中重度斑块状银屑病患者。
Skyrizi是艾伯维/勃林格殷格翰共同开发的一款IL-23抑制剂,可以通过与其p19亚基结合而选择性地阻断IL-23。2019/3/27,Skyrizi在日本首次获批上市用于治疗银屑病。除了治疗银屑病以外,Skyrizi在治疗克罗恩病方面正处于Ⅲ期临床阶段。
10.tafamidis;tafamidis meglumine
商品名:Vyndamax;Vyndaqel
公司:辉瑞
5月3日,FDA批准辉瑞Vyndaqel和Vyndamax用于治疗野生型或遗传性转甲状腺素蛋白淀粉样变心肌病(ATTR-CM)。
ATTR-CM是一种由TTR的不稳定性造成的致命罕见疾病。TTR通常以四聚体的形式存在,当不稳定的四聚体解离后,会导致折叠错误的TTR聚集并形成淀粉样蛋白原纤维和淀粉样蛋白沉积。这些淀粉样蛋白在心脏中的沉积会导致心肌变硬,最终引起心力衰竭。通常,ATTR-CM患者只有在症状变得严重之后才能被确诊。据统计,在美国,约有10万例ATTR-CM患者,而只有1%~2%的患者被确诊。
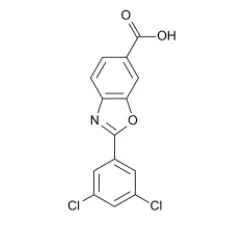
Vyndaqel(tafamidis葡甲胺)和Vyndamax(tafamidis)是口服转甲状腺素蛋白(TTR)稳定剂,它通过与TTR特异性结合,稳定TTR的四聚体形态,从而延缓导致ATTR-CM的淀粉样蛋白沉积的产生。Vyndaqel曾获得FDA授予的快速通道资格和突破性疗法认定。
11.alpelisib
商品名:Piqray
公司:诺华
5月24日,FDA批准诺华Piqray(alpelisib)上市,用于联合氟维司群治疗接受过内分泌疗法后疾病进展的HR+、HER2-的PI3Kα突变绝经后女性乳腺癌患者。这是首个获批治疗乳腺癌的PI3Kα抑制剂。
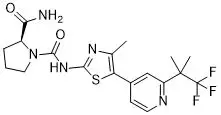
PIK3α基因突变在HR+、HER2-晚期或转移性乳腺癌患者中占到大约40%。FDA此次批准alpelisib主要基于代号为SOLAR-1的随机、双盲、III期研究结果。572例携带PI3α基因突变的HR+/HER2-晚期或转移性乳腺癌患者分别接受alpelisib+氟维司群或安慰剂+氟维司群的治疗。结果显示,alpelisib治疗组可显著提高患者的中位无进展生存期(11 vs 5.7个月)。
12.onasemnogene abeparvovac-xioi
商品名:Zolgensma
公司:诺华
5月24日,FDA批准诺华基因疗法Zolgensma(onasemnogene abeparvovac-xioi)上市,用于治疗两个编码运动神经元生存蛋白(SMN)的SMN1等位基因上携带突变的2岁以下脊髓性肌肉萎缩症(SMA)患者。
脊髓性肌萎缩症是一种罕见的致命性遗传病,主要影响肌肉力量和运动,患者主要表现为全身肌肉萎缩无力,身体逐渐丧失各种运动功能,甚至是呼吸和吞咽。发病年龄、症状和进展速率具有很大的变异性。脊髓性肌萎缩症是2岁以下婴幼儿群体中的头号遗传病杀手,在新生儿中的患病率为1:6000-1:10000,中国大约有患儿3~5万人。
Zolgensma是首个获批用于治疗SMA的基因疗法,它将能够表达SMN蛋白的正常基因装载在AAV9病毒载体中,然后通过静脉输注给药,使得患者体内能够持续表达SMN蛋白。这样一款“针对疾病根源,有一次性治愈预期效果”的疗法,诺华给出的定价是212.5万美元。
13.polatuzumab vedotin-piiq
商品名:Polivy
公司:罗氏
6月10日,FDA批准罗氏Polivy(polatuzumabvedotin-piiq)上市,用于联合苯达莫司汀+利妥昔单抗治疗先前至少接受过两次治疗的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的成人患者。
DLBCL是非霍奇金淋巴瘤(NH)的最常见形式,约占NHL患者的三分之一。DLBCL侵袭性很强,通常只对前线治疗有反应,患者复发概率高达40%,而一旦复发,治疗选择就会变得非常有限,并且生存期较短。在美国,2019年估计有2.5万例确诊的DLBCL患者。
Polivy是一种first-in-class的抗CD79b抗体偶联药物。CD79b蛋白在大多数B细胞中都有特异性表达,Polivy能够与CD79b特异性结合,并释放抗癌剂来破坏这些B细胞,使其对正常细胞的影响降到最低。
14.bremelanotide
商品名:Vyleesi
公司:Palatin Technologies
6月21日,FDA批准Vyleesi(bremelanotide)上市,用于治疗绝经前女性的机能减退性欲障碍(HSDD)。
Vyleesi是Palatin Technologies公司研发的一种黑皮质素受体激动剂,通过激活大脑中的内源性途径来调节性欲和性反应。Vyleesi没有第一款女性伟哥Addyi的低血压、眩晕等不良反应,也没有“需要提前几周服用、禁酒”等不人性的缺陷,唯一美中不足的是需要大腿皮下注射给药,大多数患者每月使用Vyleesi两到三次,每周不超过1次。注射后30分钟即可起效,疗效可持续8个小时。
2017年2月,AMAG Pharmaceuticals获得该药物在北美的独家权利。2017年9月6日,复星医药获得该药(包括原料、药物制剂和药物递送装置)在中国(包括大陆、台湾、香港及澳门特别行政区)的独家商业化和非独家开发、制造权利,交易总额1.05亿美元,其中包括500万美元首付款。



 扫码下载智通APP
扫码下载智通APP