国内首家递交美国FDA新药上市申请 石药(01093)研发转型升级
本文来自“EBoversea 光大海外”,作者为小伟、君周、佳青,本文观点不代表智通财经观点。

事件
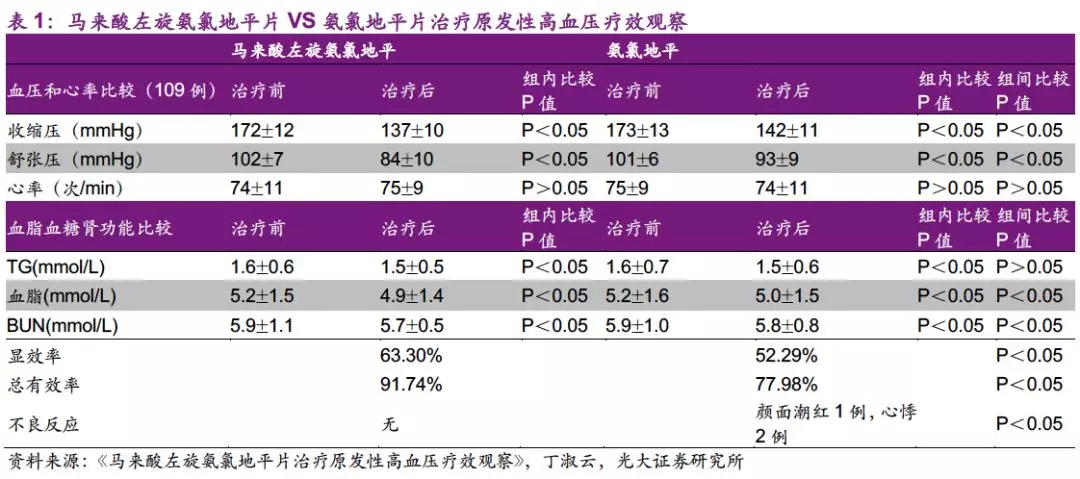
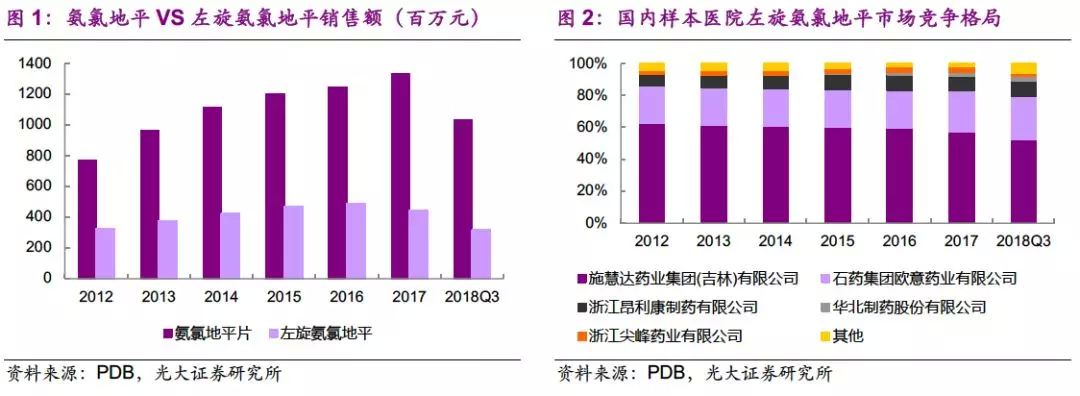
3月5日,石药(01093)公告就马来酸左旋氨氯地平片向美国FDA提交新药上市申请。左旋氨氯地平为用于治疗高血压的纯化(S)-氨氯地平,与消旋氨氯地平比,外周水肿和面部潮红等不良反应发生率较低。公司在美国的临床开发是以中国的疗效数据和安全性资料为根据,于18年10月与美国FDA进行新药上市申请前会议,并于12月完成关键性临床研究。
点评
国内首家药企向FDA提交NDA,证明公司强大的国际化能力。公司向美国FDA提交马来酸左旋氨氯地平片NDA是国内药企中的首例,美国新药上市申请的审评时间约为12个月。该药在中国进行了超过万人试验(LEADER研究),美国临床开发是以中国临床数据为依据,迅速完成桥接试验并通过505b2形式申报上市。氨氯地平是由辉瑞开发的第三代钙通道阻滞剂,05年原研络活喜全球销售额高达47亿美元,专利过期后销售额迅速下降,18年络活喜美国销售额约3600万美元。虽然该品种在美国市场销售额增量有限,但我们认为公司此次能作为国内首家成功提交美国NDA,证明了公司药政团队的国际化能力和未来海外拓展能力。
分拆附属公司新诺威A股上市获批复,保健品业务有望加快发展。近日,附属公司新诺威A股上市已获证监会批复,预计将于12个月内赴深交所上市。我们认为,拆分新诺威于A股上市有利于拓宽其融资渠道、降低融资成本,有利于加强保健产品的业务发展,有利于提高该业务分部的市场规模和利润贡献,符合公司及股东利益。
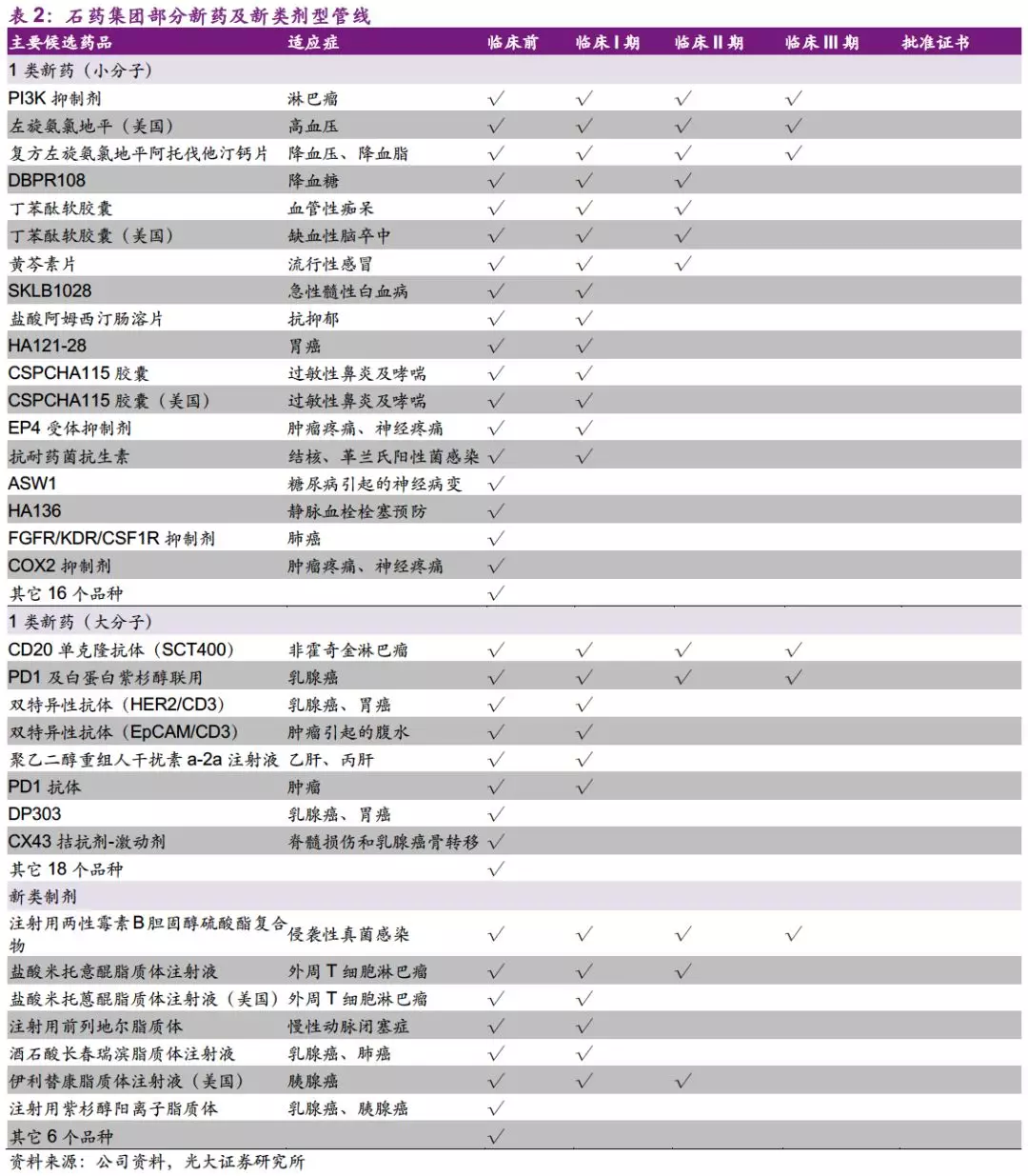
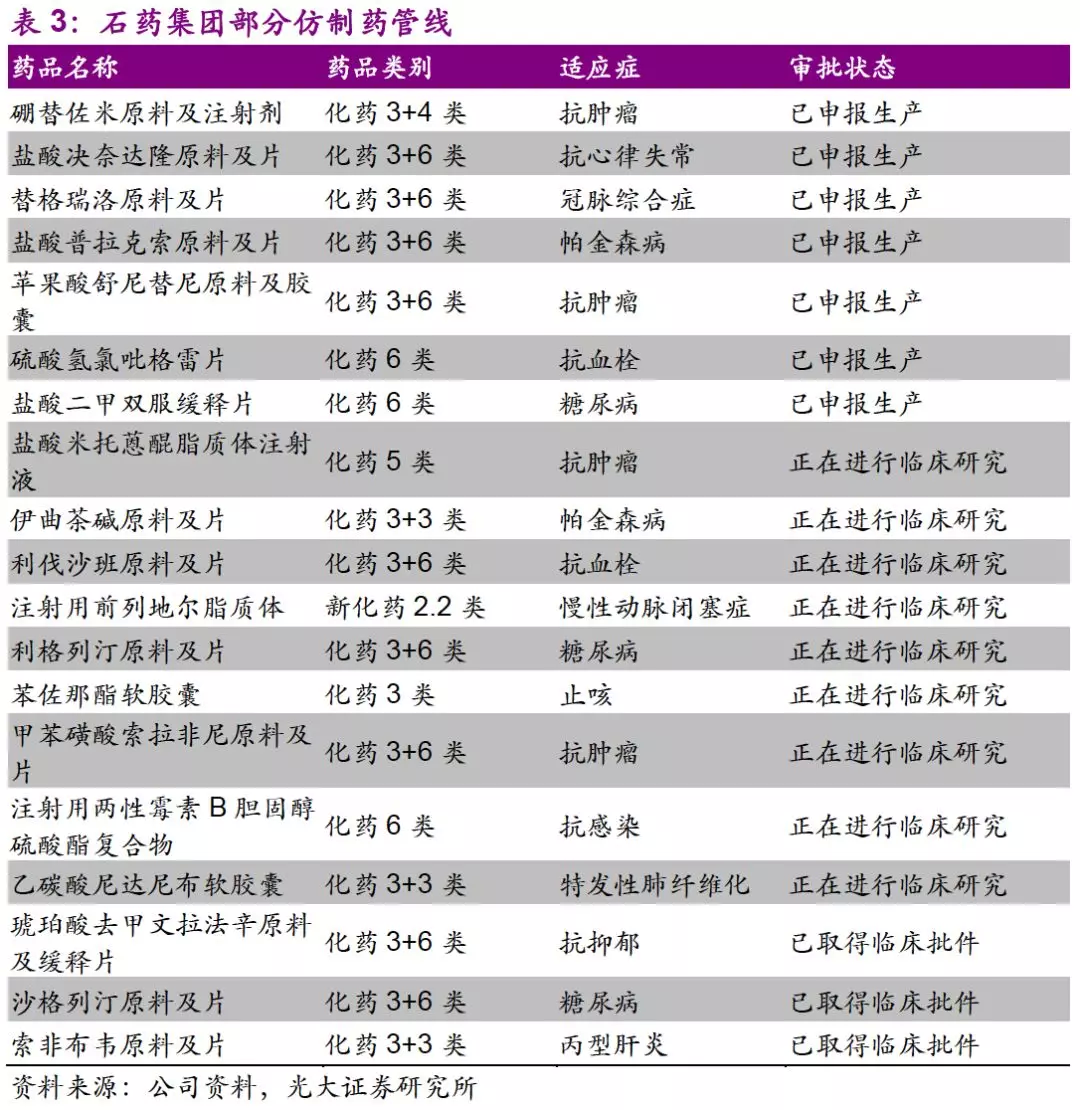
并购动作不断,研发管线持续丰富。公司研发投入不断加大,18Q3投入11亿港元(+128.5%),目前在研约200个品种。公司积极通过并购获取新品种:19年1月,以0.25亿元首付款收购英创医药5个小分子肿瘤新药的独家开发和商业化权利;以2.5亿元收购永顺100%股权,其拥有针对2个单抗药的3个新药临床试验批件;19年2月,以0.24亿元首付款收购上海药物研究所的4个小分子肿瘤药的独家开发和商业化权利。
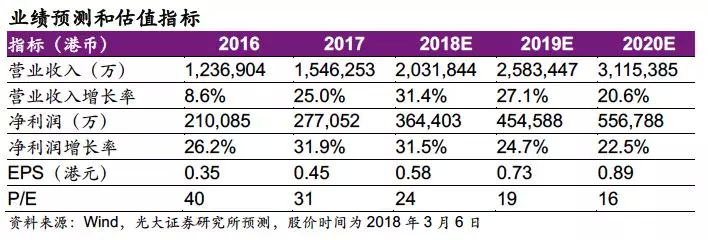
维持“买入”评级:公司是国内创新药龙头之一,业绩保持稳健较快增长,我们维持预测公司18-20年EPS分别为0.58/0.73/0.89港元,同比增长31.5%/24.7%/22.5%,当前股价对应18~20年估值分别为24/19/16x,维持“买入”评级。
风险提示:原料药价格波动,审批政策风险,研发不及预期。
附录

(编辑:朱姝琳)



 扫码下载智通APP
扫码下载智通APP