信达生物(01801)用于治疗实体瘤的两款创新ADC在中国获批临床
作者:
智通财经 徐文强
2024-03-19 16:59:09
信达生物(01801)开发的IBI130获批临床,拟开发用于不可切除的局部晚期或转移性实体瘤。
智通财经APP获悉,3月19日,中国国家药监局药品审评中心(CDE)官网公示,信达生物(01801)开发的IBI130获批临床,拟开发用于不可切除的局部晚期或转移性实体瘤。而在几日前(3月13日),该公司开发的IBI129也刚在中国获批临床,拟开发用于治疗晚期恶性实体瘤。
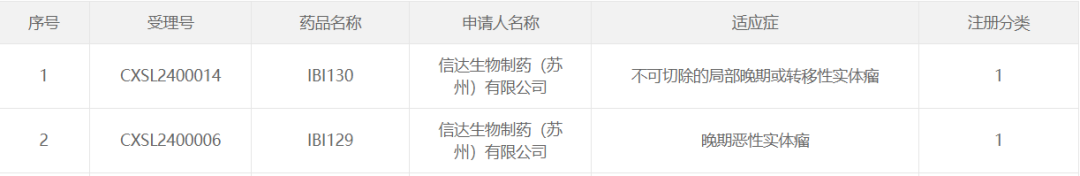
根据信达生物官网信息,IBI130是一款靶向TROP2的抗体偶联药物(ADC),IBI129是一款靶向B7-H3的ADC。据了解,目前,IBI129已进入到1期临床试验阶段。根据中国临床试验登记与信息公示平台,信达生物已于日前登记了一项国际多中心1/2期临床试验,旨在评估IBI129治疗局部晚期不可切除或转移性实体瘤受试者的安全性、耐受性和有效性。该研究计划在中国境内入组342例患者,国际上入组362例患者。
值得一提的是,针对B7-H3靶点,信达生物开发了多款药物。除了靶向B7-H3的ADC产品IBI129,该公司还开发了:IBI334,一种新型抗体依赖性细胞毒性(ADCC)增强的B7-H3/EGFR双特异性抗体;IBI3001,一种靶向B7-H3和EGFR的双特异性ADC。IBI334和IBI3001各有一项研究入选本届2024年美国癌症研究协会(AACR)年会的Late-Breaking Research环节。
智通声明:本内容为作者独立观点,不代表智通财经立场。未经允许不得转载,文中内容仅供参考,不作为实际操作建议,交易风险自担。更多最新最全港美股资讯,请点击下载智通财经App
相关阅读
平安健康(01833)发布2023年全年业绩:战略业务强势增长 亏损加速收窄47.6%
2024-03-19 16:57
徐文强
MEGA订单量不及预期 理想汽车(02015)遭遇“滑铁卢”
2024-03-19 16:19
徐文强
新股暗盘 | 荃信生物-B(02509)暗盘盘初涨超40% 每手赚1650港元
2024-03-19 16:16
叶志远
小鹏汽车-W(09868)业绩揭榜在即 颓势能否扭转?
2024-03-19 16:10
陈雯芳
Schroders PLC减持中国太保(02601)1534.3万股 每股作价约14.04港元
2024-03-19 15:15
陈雯芳



 扫码下载智通APP
扫码下载智通APP