耐立克®新适应症获批巩固BIC实力,亚盛医药-B(06855)造血潜能加速兑现
作为中国首个且具全球best-in-class实力的第三代BCR-ABL抑制剂,2021年11月获批上市的耐立克®填补了国内携T315I突变慢粒患者在治疗耐药后的治疗空白。
上市两年来,耐立克®凭借全球同类最佳潜力的创新属性屡获国际学界的高度认可。今年,亚盛医药-B(06855)的在研新药有多项临床进展获选第65届美国血液学会(ASH)年会,其中便有2项耐立克®相关研究获口头报告。这是该品种临床进展连续第6年入选ASH年会口头报告。
而在亚盛医药创新研究再度获得国际学界充分背书的同时,二级市场上公司股价与市值也在水涨船高。
智通财经APP观察到,今年10月至今,在核心产品研发及商业化成果利好的激励下,亚盛医药股价走出了一波向上行情,10月5日至11月17日,公司区间股价最高涨幅达到45.1%,盘中最高股价达到28港元,为今年9月以来的新高。
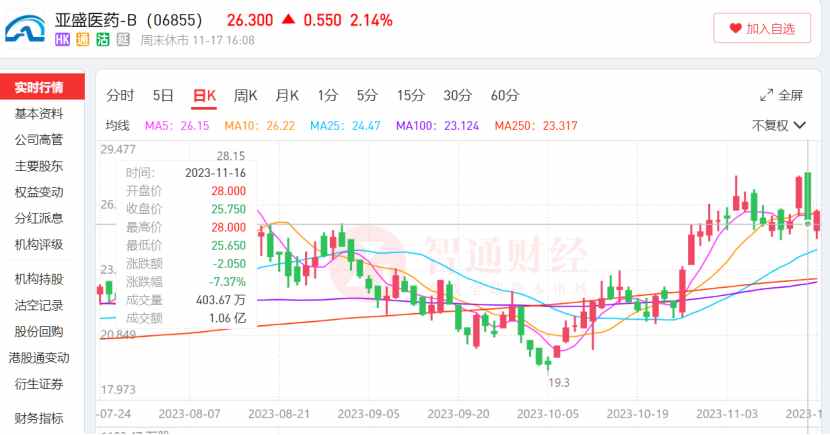
但当前行情显然还未到达高潮。11月17日,亚盛医药宣布,耐立克®正式获批用于治疗对一代和二代酪氨酸激酶抑制剂(TKI)耐药和/或不耐受的CML慢性期(-CP)成年患者。
此次耐立克®新适应症获批最大的亮点在于:从两个获批适应症对应的患者群体规模来看,TKI耐药CML患者远远超过T315I突变人群,进一步保证了耐立克®后续销售额能够继续大幅增长,也为亚盛医药接下来的跃估值迁奠定了良好基础。
为更广阔患者带来治疗新选择
作为亚盛医药的原创1类新药,耐立克®此前已获国家“重大新药创制”专项支持,具有全球同类最佳实力。该品种治疗携T315I突变耐药慢性髓细胞白血病的适应症已于2021年11月获批,并在今年1月获纳入国家医保目录。这打破了中国伴T315I突变耐药慢粒患者长期无药可医的困境,并让患者“用得起”,填补了国内临床治疗空白。
自耐立克®获批上市以来,亚盛医药在推动其商业化的同时还在致力于深挖其在更广阔适应症的治疗潜力。此次顺利攻克TKI耐药CML适应症便是典型案例。
据智通财经APP了解,目前仍有20%至40%的患者会在TKI治疗过程中因耐药或不耐受而治疗失败。而此次耐立克®治疗一代和二代TKI耐药和/或不耐受的慢性期慢粒患者适应症的获批,将进一步打破慢粒治疗领域的耐药困境。
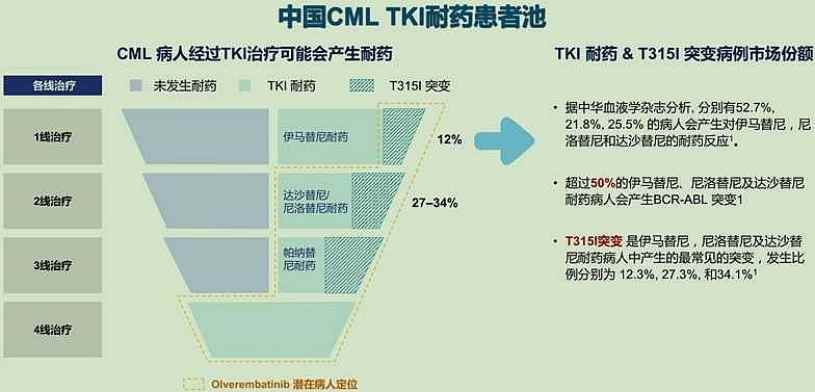
在此次ASH年会上,耐立克®一项入选口头报告的研究正是支持上述适应症获批的关键注册II期临床结果。
公司即将展示的临床数据显示,在既往TKI耐药/不耐受的慢性期慢粒患者中,与对照的现有最佳疗法(BAT)治疗组相比,耐立克®治疗组治疗组将mEFS从2.86个月大幅延长至21.22个月,事件风险降低65%,在无事件生存期(EFS)显示了统计学和临床上显著意义的改善,达到了本研究的主要研究终点。该研究也进一步巩固了耐立克®在CML适应症的统治力。

2022年7月,CDE受理了耐立克®该适应症的上市申请并将其纳入优先审评程序。随着如今治疗既往TKI耐药和/或不耐受的CML慢性期患者的新适应症获批,耐立克®显然将有望实现新一轮的市场增长。
此外,亚盛医药在美国临床研究中发现,耐立克®对第三代BCR-ABL抑制剂ponatinib耐药的患者也有较明显的疗效。因此,公司也在跟FDA进一步沟通中,推动产品的注册临床获批,以期在美国能够尽快地上市,让全球更多的患者获益。
深挖产品价值,造血潜能持续兑现
作为公司首个上市品种、国产重大创新药代表,耐立克®在终端市场显示出的先发优势,也是亚盛医药造血潜能得以持续兑现的重要保障。
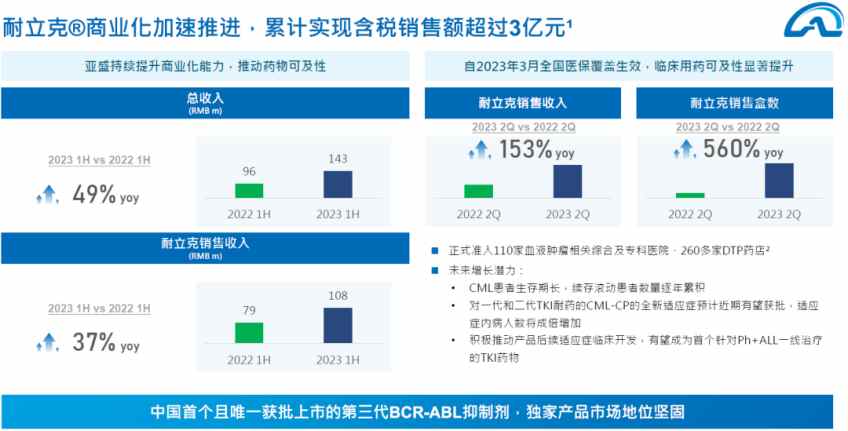
以今年公司中期业绩为例,报告期内,亚盛医药收入获得大幅增长,实现收入人民币1.43亿元,较去年同期增长49%。整体收入大幅增长的背后是耐立克®在今年1月获纳入新版国家医保药品目录后放量显著。
事实上,从历年医保谈判结果来看,药品的创新性不断提升,具有高临床价值的品种在谈判降价进入医保后大多实现了销售额的显著增长。
以耐立克®为例,作为医保谈判国家医保局重点提及的创新药标杆,耐立克®仅以极小的降幅(实际价格)完成了医保准入,远超行业预期。因此在今年1月获纳入新版国家医保药品目录后,在医保体系的支持下,公司中报数据显示当期耐立克®放量显著,实现销售收入1.08亿元,较去年同期增长37%,其中第二季度销售额同比增长153%,盒数同比增长560%,进一步提升了亚盛医药的造血功能。
而此次耐立克®新适应症的获批最大的亮点是从适应症角度来看,耐立克®由此前的“三线药物”变成一款“准二线”药物。因此投资者能够参考BSM第二代BCR-ABL抑制剂达沙替尼的销售对耐立克®未来的销售增量进行新的研判。根据BSM 财报显示,2022年达沙替尼年销售额为21.65亿美元。
值得一提的是,CML市场仅是耐立克®商业化版图的一隅,产品未来的想象空间并非止步于此。在CML之外,耐立克®另一个增长点来自费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)。
5月31日,亚盛医药才宣布耐立克®获纳入“拟突破性治疗品种”,同于治疗既往经过一线治疗的SDH缺陷型GIST患者,仅过半个月,公司再度宣布耐立克®用于治疗复发性费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)儿童患者的成果。
在今年召开的2023欧洲血液年会(EHA)上,两项耐立克®用于成人费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)患者的最新临床数据获得壁报展示,同时耐立克®在复发Ph+ ALL儿童患者中的临床数据首次在国际期刊上发表,也证明其在ALL领域具有显著的治疗潜力和良好的安全性。
从该适应症市场潜力来看,一份去年由国家癌症中心发布的中美两国癌症数据对比报告显示,中国2022年预估新发白血病病例近9万例。据悉,ALL在所有白血病中占约10%-15%,Ph+ALL约占成人ALL的30%~40%,拥有较大的患者基数。
而在市场竞争方面,目前ponatinib在国内开展TKI复发/耐药Ph+ALL的I/II临床研究,结合其安全性风险,ponatinib与耐立克®在一线治疗市场难以构成直接市场竞争。因此,耐立克®在国内Ph+ALL一线治疗市场中赢得大部分市场份额的确定性极强,这一适应症也将为耐立克®带来十分可观的市场增量。
而亚盛医药也在通过进一步完善国际化生产和质量管理体系,将核心品种的销售潜力势能转化为公司销售增长的动能。
在生产和质量管理体系建设方面,继去年获准核发药品生产许可证(A证)后,亚盛医药于今年4月获得由欧盟质量受权人(Qualified Person, QP)签发的GMP(药品生产质量管理规范)符合性审计报告,公司全球产业基地零缺陷通过欧盟QP审计。这意味着未来无论在产品交付速度,还是在上市进展上,亚盛在生产端都有了扎实的基础。
不难看到,从CML到Ph+ ALL,再到SDH缺陷型GIST,亚盛医药在耐立克®的适应症开发与拓展,始终聚焦于临床上尚未满足治疗需求的患者。而在这一开发理念下,集研发、生产和商业化于一体的体系化竞争优势于一身的亚盛医药,作为一家手握重磅商业化产品、兼具持续造血和差异化创新能力的头部企业,也将凭借强大的创新产品和技术的收入转化能力,在新的上行周期中加速价值兑现和估值反弹。



 扫码下载智通APP
扫码下载智通APP