亘喜生物(GRCL.US):现金流充足仍“断臂自救”,聚焦核心产品能否挽回估值?
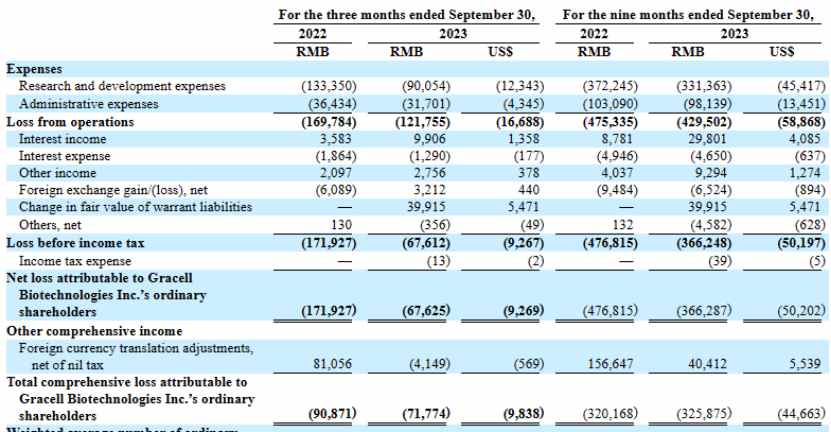
11月13日美股盘前,亘喜生物(GRCL.US)公布了其2023年Q3季度财报。数据显示,亘喜生物Q3季度净亏损为6760万元(人民币,下同),较上年同期净亏损1.72亿元实现大幅收窄。而其背后,是亘喜生物研发费用的大幅减少,公司当期研发支出约为9010万元,较上年同期的1.33亿元减少约32.5%。
实际上,作为一家成立不过6年的生物技术企业,亘喜生物虽已有产品进入临床阶段,且研发进展迅速,但是至今仍没有产品进入到商业化阶段,因此公司在二级市场还是较难获得认可。
从今年以来的股价趋势看,亘喜生物的整体股价始终在7美元以下徘徊,而全年仅有的2次较大行情则与其在国际会议上披露关键数据相关。可以说,当前重磅产品的关键数据是否符合市场预期,直接关系到亘喜生物的市场估值。
靠“数据”驱动的股价
对于亘喜生物来说,其驱动股价的因素或许不在于定期披露的财报,而在于其随开发进程披露的临床数据。
在今年Q3财报中,亘喜生物提到,决定进一步将资源重点聚焦于加速推动旗下高度创新、具有差异化优势的候选产品的临床开发,包括GC012F、GC506等临床阶段产品;因此暂停供者来源异基因疗法GC007g针对B-ALL适应症的2期临床试验。
也就是说,随着公司研发策略调整,核心产品GC012F、GC506的研发进度和相关临床数据对公司估值影响的权重将进一步变大。事实上,今年以来,围绕GC012F在各种国际会议上披露的数据,亘喜生物的股价便有不同程度的波动。
以今年上半年为例,GC012F治疗RRMM和r/r B-NHL的研究成果分别入选了2023 ASCO和EHA2023的口头报告。
具体来看,在今年ASCO期间,亘喜生物以口头报告形式公布了GC012F用于治疗复发/难治性多发性骨髓瘤(r/r MM)和B细胞非霍奇金淋巴瘤(B-NHL)的长期随访数据。数据显示,针对r/r MM,GC012F延续了此前的强势表现,总体应答率(ORR)高达93.1%,这意味着绝大部分患者对治疗有积极响应。
而在今年的EHA年会上,亘喜生物则以口头报告形式公布了GC012F针对既往接受过重度治疗,且呈现高肿瘤负荷的9例B-NHL患者的临床数据:治疗3个月后,ORR达到100%,CR率为78%;到六个月时,CR率仍维持在67%。以上患者均属于临床上非常棘手的一种B-NHL亚型DLBCL。GC012F在该适应症上展示的临床有效性或将为患者提供新的治疗选择。
另外在安全性方面,在接受GC012F治疗的r/r MM患者中,只有7%的患者出现3级以上的CRS,而任何情况的ICANS均没有发生;在B-NHL患者中,也是只有1名患者出现3级以上的CRS,无任何ICANS发生。并且在GC012F的临床研究中均未观察到第二原发性恶性肿瘤(SPM)。
对应二级市场表现来看亘喜生物股价虽然在4月26日盘中跌至今年新低1.4美元,但在以上新披露的临床数据支撑下,公司股价在2个半月内股价最高回升至6.99美元,区间涨幅达399.29%。
此后,公司股价再度在4个月内大幅下滑至2.1美元。不过从10月4日至11月14日,亘喜生物的股价再度走强。结合公司公告和财报信息得知,其即将在12月9日至12日举办的美国血液学会(ASH)年会上口头报告一项由研究者发起的临床试验(IIT)的最新研究结果。该试验旨在评估BCMA/CD19双靶点自体CAR-T细胞疗法GC012F治疗高危多发性骨髓瘤新确诊(NDMM)患者的安全性和有效性。
在去年ASH大会上,亘喜生物便公布了相关临床13例患者的首次临床数据。随着更多患者入组治疗,以及既往患者的随访时间不断拉长,他们观察到GC012F持续展现出较好的应答深度及安全性优势。正是基于这一向好数据的预期,亘喜生物的估值在ASH大会召开前再度上涨。也由此能够看出,亘喜生物股价因关键临床数据披露引发的“潮汐效应”明显。
“断臂自救”之后前景如何?
相较于今年Q1和Q2季度的财报,亘喜生物在Q3财报中体现出的“断臂自救”耐人寻味。
据智通财经APP了解,在此前披露的Q2财报中,亘喜生物披露了其在研的供者来源异基因疗法GC007g针对B-ALL适应症的临床试验,并指出其在EHA2023上首次发表了1期临床试验数据,显示100%的患者达到MRD阴性的完全缓解/血细胞数量未完全恢复的完全缓解(CR/CRi)。当时亘喜生物还表示GC007g的2期临床试验正在进行中。
但在Q3财报中,亘喜生物以“调整管线开发优先级”为由暂停了以上产品的II期研究。

其实这并非亘喜生物现金流缺乏,相反在今年8月10日成功完成一轮配售融资后,截至Q3,公司当前持有现金、现金等价物和短期投资达到17.08亿元(折合2.34亿美元),较Q2季度11.88亿元,环比增长43.77%。且亘喜生物在配售融资后表示:融资总所得资金加上账上现金及现金等价物,预计将支持公司日常运营至2026年下半年。
这就意味着,“断臂自救”并非因为现金问题,而是将公司重心放在核心产品的开发进度上。可以看到,由于没有商业化产品,目前亘喜生物主要靠市场融资维持研发和运营,虽然目前现金储备较为充足,但缺乏造血能力依然严重压制了公司的估值。
对于亘喜生物来说,尽快推动通用型CAR-T产品GC012F获批上市,才是释放估值潜力的关键举措。但如今不同以往,在GC012F针对的复发/难治性多发性骨髓瘤(RRMM)市场已然出现众多来自双抗赛道的竞争对手。
据智通财经APP了解,在ASH 2022年会上,强生/杨森公布了其GPRC5D/CD3双抗Talquetamab治疗复发性或难治性多发性骨髓瘤(R/R MM)的1/2期临床研究结果。数据分析显示,Talquetamab在既往接受过多线治疗的RRMM患者中,显示出良好的疗效和可控的安全性。
血液肿瘤是双特异性抗体的“最热门”领域。据统计,截至目前,全球在研双抗逾800项,适应症包含血液肿瘤的双抗达到了155个,将近占到了20%。不难看到,多发性骨髓瘤作为在血液肿瘤领域第二大常见恶性肿瘤已有多款在研双抗正在布局。
根据Fortune Business Insights的报告,2018年全球多发性骨髓瘤市场规模为约195亿美元,预计到2026年将达到约310亿美元,预测期间年复合增长率将为6.0%。在如此庞大的市场规模和临床需求下,多发性骨髓瘤无疑是各大药企兵家必争之地。
另外,由于双抗同样也是现货产品,与GC012F或将在同一市场竞争区间。因此,未来亘喜生物靠单一的且竞争日趋激烈的血液瘤市场显然不足以撑起后续商业化的故事。因此亘喜生物也开始向自免市场靠拢。今年5月16日,亘喜生物宣布启动GC012F针对难治性系统性红斑狼疮(SLE)的临床试验。
根据公司Q3财报披露,公司正在中国开展评估GC012F治疗rSLE的IIT研究,推进患者入组和给药。公司预计今年年内在美国及中国递交1期临床试验的IND申请,并预计将在2024年上半年发表初步临床数据。
虽然市场竞争层面来看,目前国内针对SLE治疗药物中上市的生物制剂仅荣昌生物的泰它西普和葛兰素史克(GSK)的贝利尤单抗2款,竞争水平较低。但由于亘喜生物相关研究进度尚在临床前阶段,与竞品存在较大差距,因此聚焦核心产品和新适应症研究,对亘喜生物而言显然更具性价比。
但从二级市场的角度来看,公司短期内或仍难摆脱“数据”驱动股价的逻辑,且整体估值也会因缺乏造血而被压制。



 扫码下载智通APP
扫码下载智通APP