中国版《孤药法案》搭台,国内创新药企唱戏
数据显示,我国有超过2000万名罕见病患者,并且每年罕见病新增患者数超过20万。在此背景下,中国版《孤药法案》(OrphanDrugAct)出台意味着什么?
智通财经APP了解到,5月9日,国家药监局发布《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》(以下简称征求意见稿),并向社会公开征求意见。该征求意见稿全篇约3万字,共十章181条,与现行《中华人民共和国药品管理法实施条例》共十章80条相比,增加了101条。
其中在罕见病方面,此次新版征求意见稿提出:罕见病新药在不断供情况下拥有不超7年的市场独占权,期间不再批准相同品种上市。
简言之,该政策的核心设计思路就是,通过向企业让利,增大其投入研发罕见病研发的动力。让罕见病市场先实现“有药可用”,优先满足罕见病患者庞大且强烈的未满足治疗需求。
因此,此次征求意见稿及后续法规的颁布或将对国内罕见病治疗市场产生较为深远的影响。
罕见病领域“摸着鹰酱过河”
如今,提到罕见病药物开发,全球业界无不称赞美国、欧盟和日本的制药巨头。先看看这些药企近年来在罕见药治疗方面的布局。
2018年4月,武田收购罕见病巨头英国夏尔(Shire),成为罕见病第一巨头;2018年,赛诺菲以116亿美元收购美国专攻血液罕见病公司Bioverativ;2021年9月,默沙东宣布以115亿美元收购Accelron,着手布局罕见病领域;2021年12月,阿斯利康宣布与IonisPharmaceuticals就一款在研孤儿药eplontersen达成超35亿美元的全球开发和商业化协议;2022年4月,葛兰素史克以19亿美元收购罕见癌症靶向治疗公司Sierra。
另外据统计,2020年美国FDA批准的40个新分子实体,有22个获孤儿药指定,超过获批总数的一半。目前,全球超过80%的跨国药企都布局了罕见病领域。
乍一看,似乎所有的西方制药巨头都在扎堆罕见病药物研发。相比之下,在国内制药业,近年来慢性病早已是红海一片,蓝海无限的肿瘤药也开始走出国门,但罕见病却刚刚开始考虑把药引进来。从表面上来看,国内制药业似乎已经输在了罕见病治疗研发的起跑线。但深层因素并非如此。
对于现代制药企业而言,相比于考虑治病救人,研发新药更多考虑的是开发成本与上市利润的博弈。罕见病新药研发正好体现了二者间最尖锐的矛盾。
几乎所有的罕见病药物研发都存在两个短板问题:前期新药临床试验入组招募患者难;后期销售环节寻找买单患者难。研发投入与最终收获不成正比是罕见病新药难以在完全市场化环境下诞生的根本原因。
以美国为例,1962年,美国颁布的《基福弗—哈里斯修正案》(Kefauver–HarrisAmendments),要求药厂需要向政府部门提供严格的新药的有效性及安全性的临床试验证据,随后新药才能在一个国家上市。1970年,FDA要求制药商提交新药申请时必须附上RCT(随机对照试验)结果,进一步加强药物上市的限制。
以上政策极大增加了药企研发药物的成本,以致于当时众多美国药企多将研发精力更多地投入在糖尿病、高血压等常见病中,以大适应症市场维持公司的利润。
为了解决罕见病无人问津的局面,美国的解决方案是用让利政策自上而下引导市场。
1983年和2002年,美国相继出台了《孤药法案》和《罕见病法案》。其中,《孤药法案》提出为罕见病新药增加了新的优惠政策——7年垄断经营权,即监管部门在某罕见病新药上市后的7年内不会再批准其他类似的用于治疗相同疾病的罕见病药物。
这一让利政策吸引企业的原因关键在于,垄断和自主定价权。这两项特权意味着企业可以为罕见病新药定出高昂的天价以弥补前期的投入,并获取丰厚利润。
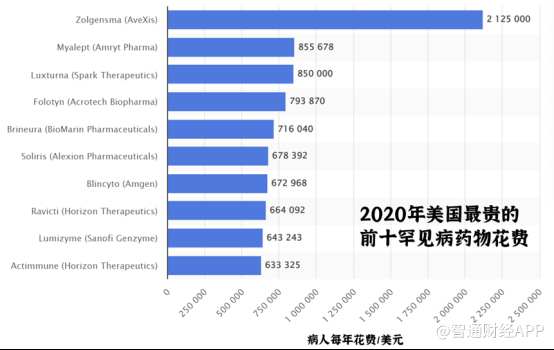
数据显示,2020年美国最贵的前十罕见病药物费用均在每年60万美元以上,最高超过了200万美元。
结合全球罕见病治疗市场来看,全球罕见病药物市场规模将由2020年的1351亿美元增至2030年的3833亿美元,年复合增长率高达11%。千亿级市场叠加丰厚的药物单价,逐利的跨国药企的积极性显然被极大调动。
之所以国内药企的积极性不如其他跨国药企,有个关键点在于,日本版《孤药法案》于1993年出现,欧盟版本于2000年出现,而此前国内尚无类似的法规出台。
由于在当前市场环境下,我国与美国等国际市场当年面临的问题类似,即切实解决罕见病市场“无药可用”的主要矛盾。因此,此次征求意见稿“摸着鹰酱过河”,符合我国的当前国情以及市场客观规律,对国内罕见病治疗市场的促进作用显而易见。
国内药企面临的机遇与挑战
与美国《孤药法案》类似,此次国内征求意见稿及后续法规颁布后,在国内罕见病治疗市场,“政策搭台,企业唱戏”的局面将进一步形成及完善。对于国内各大创新药企而言,既是机遇亦是挑战。
首先,此次政策提出为国内广阔的罕见病治疗蓝海进一步“清理了暗礁”。
从国内的政策规划来看,2018年国家卫生健康委等五部门联合发布了《第一批罕见病目录》,首次明确了121种罕见病,影响患者超过300万人;国内还对进口罕见病药品,减按3%征收进口环节增值税;建立全国罕见病诊疗协作网;为临床急需罕见病新药开设审评审批绿色通道;去年10月,CDE还发布了《罕见疾病药物临床研发技术指导原则(征求意见稿)》,鼓励建立标准化患者登记系统。
此前,支付难题以及无市场独占权一直都是国外研发罕见病药物的跨国药企大规模进入国内市场的重要阻碍。近年来,国内逐步探索出的“1+N”多方共付已成为罕见病用药保障机制的共识,现已有29个省市以多种报销模式实施罕见病保险政策。
而此次“七年独占权”的设立,则让国内罕见病治疗市场进一步与国际接轨,让国内创新药企拥有了更好的政策环境。
此外,国内创新药企也可以通过研发罕见病适应症加快产品审评审批。
征求意见稿第二十九条提到,国家鼓励罕见病药品的研制和创新,支持药品上市许可持有人开展罕见病药品研制,鼓励开展已上市药品针对罕见病的新适应症开发,对临床急需的罕见病药品予以优先审评审批。在药物研制和注册申报期间,加强与申办者沟通交流,促进罕见病用药加快上市,满足罕见病患者临床用药需求。
实际上,早在2019年正式施行的药品管理法中便提到,对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药予以优先审评审批。此次将罕见病药物单独列出强调了国内政策对罕见病药物优先审评审批的支持。
通过罕见病适应症通道获批上市,一直是国外通行的新药开发策略。例如,新基(Celgene)公司开发的来那度胺(Revlimid)就是以孤儿药资格先申报上市的,此后在美国和欧洲相继获批用于十多种罕见病症的治疗方案中。现在来那度胺已成为全球肿瘤市场的畅销药(2020年销售额121亿美元)。
据智通财经APP了解,FDA自2011年至2020年10年间,共有1256个罕见病药物开发项目,期间共批准了184个用于罕见病适应症的药物,仅2020年,就有31个罕见病药物获批上市,占该年度批准的创新药总数的58%。
近年来,国内创新药企也正通过孤儿药开发策略加速产品的审评进程。2020年共有19家中国公司的26款产品获得了35项FDA孤儿药资格,占FDA全年授出孤儿药资格数量的8%。以港股上市的亚盛医药-B(06855)为例,近年在疫情下仍斩获十余项FDA孤儿药认证,创下国内药企之最。
对于国内创新药企而已,中国版《孤药法案》的落地也将对其带来一定挑战。
在罕见病治疗领域更为激烈的市场竞争自然不必多说。相较全球顶尖的跨国药企,国内药企大多尚处于创新转型期,新药研发能力有待提高。从国际比较看,根据美国国家科学基金会(NSF)发布的《2018科学与工程指标》,我国基础研究经费投入力度与世界科技强国相比存在明显不足,总量仅相当于美国的1/4,基础研究经费占R&D经费比例略高于5%,远低于美国(16.9%)、英国(16.9%)、日本(11.9%)、法国(24.4%)等世界科技强国。
在政策面逐步打消国内罕见病治疗市场的不确定性后,拥有雄厚技术实力的跨国药企将进一步深入国内市场,更先一步享受政策和市场红利,拉开与国内创新药企的差距。例如,辉瑞在去年末重调中国区组织架构,罕见病被纳入为六大独立事业部之一;阿斯利康2021年9月宣布正式成立中国罕见病业务部。
另外,上文提到,跨国药企之所以能在孤儿药研发上调动巨大积极性,关键在于垄断与自主定价权。例如,2019年FDA批准一项治疗脊髓型肌萎缩症的基因疗法——Zolgensma,其单次治疗价格为212.5万美元(约为1465.83万元人民币)。此外,如治疗脊髓肌萎缩症的诺西那生钠注射液一针售价也达到70万元,治疗法布雷病的阿加糖酶α注射液年费用则达百万。
不过,为了缓解新药成本与利润的这一供求平衡,促进良性的局面发展,近年来医保谈判成为了国内平衡“天价药”的重要机制。
数据显示,目前国内共有60余种罕见病用药获批上市,其中涉及25种罕见病的40余种药物已被纳入国家医保目录。在去年12月的国家医保谈判“灵魂砍价”后,又有7种罕见病药品谈判成功,被纳入最新版的国家医保目录,价格平均降幅达65%。
上文提到的诺西那生钠注射液作为首个被纳入国家医保目录的高值罕见病药物,去年以3.3万元/针成功通过医保谈判,降价幅度高达95%。可见,通过以价格换市场的方式,医保谈判在一定程度上限制了药企在罕见病上的药物定价。
不过国内庞大的市场以及日益完善的政策,显然更具吸引力,就在跨国药企忙着在国内孤儿药领域布局时,国内也有一批本土药企悄然兴起。
比如在港股市场,君实生物(01877)的重磅产品特瑞普利单抗已获得美国FDA授予1项突破性疗法认定、1项快速通道资格和3项孤儿药资格。
再如亚盛医药-B(06855),其在研原创新药MDM2-p53抑制剂APG-115(alrizomadlin)已获得FDA授予的儿童罕见病资格认证,用于治疗神经母细胞瘤。而APG-115已获得FDA授予的六项孤儿药资格认证(ODD)、两项RPD。
北海康成-B(01228)其核心产品Hunterase®是国内首个且唯一的全球新一代治疗MPSⅡ的酶替代疗法,拥有FDA孤儿药资格认证,且获得国家药品监督管理局的优先审评资格。
在A股市场,恒瑞医药(600276.SH)和亿帆医药(002019.SZ)等药企同样也走在罕见病药物研发之列。
近年来,在政策与市场端的多方努力下,国内罕见病在诊断、用药和支付等多方面都得到了显著改善,较大地提升了罕见病药品在国内市场的可及性。不过,当下国内罕见病患者入组困难、诊断难度大、终点指标复杂和研究周期较长等根本问题依然存在,国内罕见病治疗市场的发展依然任重道远。



 扫码下载智通APP
扫码下载智通APP