新一代PDE4抑制剂在中国申报临床 信达生物(01801)超2.6亿美元引进获授权
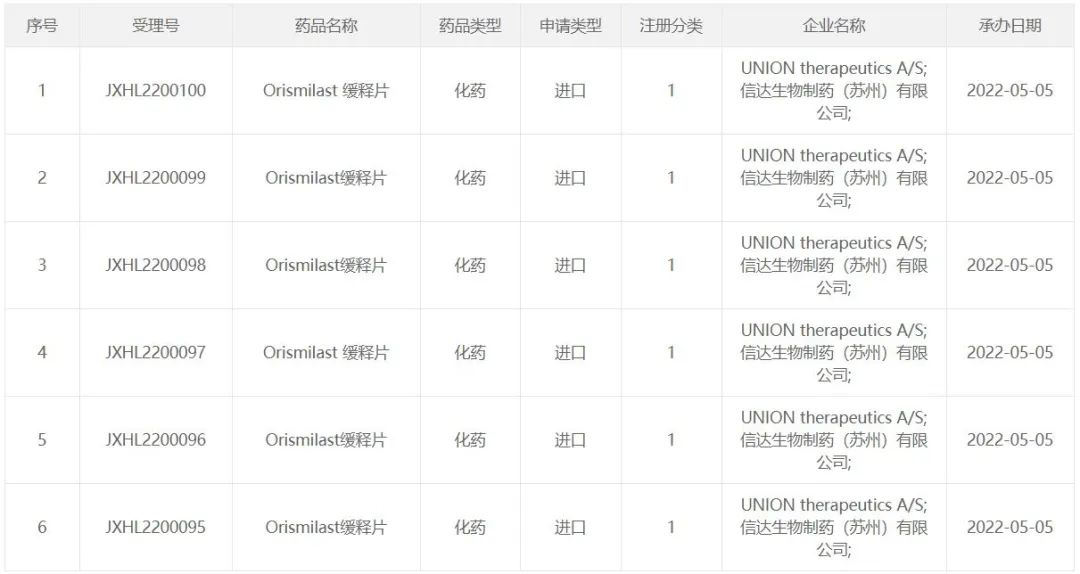
智通财经APP获悉,5月5日,中国国家药品监督管理局药品审评中心(CDE)官网公示,UNION
therapeutics和信达生物(01801)联合提交了6项orismilast缓释片的临床试验申请,并获得受理。公开资料显示,orismilast是UNION公司开发的一款下一代PDE4抑制,已获得美国FDA授予快速通道资格。2021年,信达生物通过一项超2.6亿美元的合作获得了该候选药在中国的独家授权。
PDE全称为磷酸二酯酶,是包括11个家族(PDE1~PDE11)的超级酶家族,可以催化第二信使cAMP和/或cGMP水解,对细胞代谢发挥重要作用。作为PDE家族的一员,PDE4可通过特异性水解cAMP而调控促炎、抗炎细胞因子的产生,从而发挥一系列作用。目前,研究人员正在开发PDE4抑制剂用于治疗多种炎症性疾病,包括银屑病、强直性脊柱炎、特应性皮炎、类风湿关节炎、系统性红斑狼疮等等。全球范围内已有多款PDE4抑制剂获批上市。
公开资料显示,orismilast是一种强效和高选择性的下一代PDE4抑制剂,具有广泛的抗炎特性。该药由LEO Pharma开发,并于2020年被UNION公司获得。2021年9月,信达生物宣布与UNION公司达成一项独家授权协议。根据协议条款,信达生物将获得orismilast在中国的研究、开发和商业化独家权益。UNION公司将收到2000万美元的首付款,并有权获得累计不超过2.47亿美元的里程碑付款,以及orismilast在中国年度销售净额的特许权使用费。同时,UNION公司保留orismilast在除中国以外的全球其它地区的权益。
根据UNION公司官网资料介绍,orismilast的一个潜在优势是有望在提高抗炎效力的同时减少胃肠道副作用。目前,该公司正在开发该药用于治疗特应性皮炎、银屑病、化脓性汗腺炎(HS)等适应症。2021年11月,FDA已授予orismilast快速通道资格,用于治疗中度至重度特应性皮炎。



 扫码下载智通APP
扫码下载智通APP