国家药监局:誉衡生物、药明生物(02269)PD-1已进入“在审批”状态
作者:
智通财经 楚芸玮
2021-08-18 14:22:52
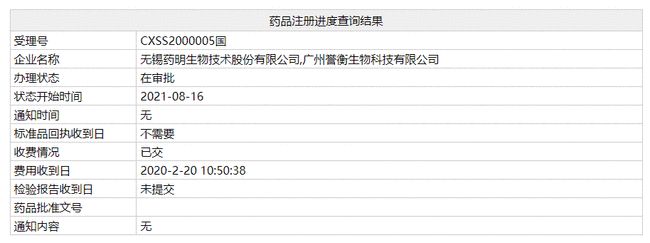
近日,国家药品监督管理局官网显示,誉衡生物、药明生物研发的抗PD-1全人创新抗体药赛帕利单抗(GLS-010)已进入“在审批”。
智通财经APP获悉,近日,国家药品监督管理局官网显示,誉衡生物、药明生物(02269)研发的抗PD-1全人创新抗体药赛帕利单抗(GLS-010)已进入“在审批”,将于近期获得NMPA批准上市,用于治疗二线以上复发或难治性经典型霍奇金淋巴瘤(r/r
cHL)患者。
GLS-010注射液是由誉衡生物委托药明生物研发,由北京肿瘤医院牵头及多家国内临床科研机构共同参与完成临床试验申报的首个由转基因动物平台筛选的全人抗PD-1单克隆抗体,具有完善的自主知识产权。
此外,GLS-010注射液在今年3月获得了CDE突破性疗法认定,用于治疗接受过一线或以上含铂标准化疗后进展的复发或转移、PD-L1表达阳性(CPS≥1)宫颈癌的新适应症。
这是即将获批的第6款国产PD-1单抗。目前国内已上市7款PD-1,其中两款来自进口,其余5款为国内自研,分别来自君实生物(01877)、信达生物(01801)、恒瑞医药(600276.SH)、百济神州(06160)和康方生物(09926)。
智通声明:本内容为作者独立观点,不代表智通财经立场。未经允许不得转载,文中内容仅供参考,不作为实际操作建议,交易风险自担。更多最新最全港美股资讯,请点击下载智通财经App
相关阅读
港股异动︱港股生物技术板块集体下跌 药明生物(02269)盘中一度跌超7%领跌板块
2021-08-17 11:46
庄东骐
港股开盘(8.16)︱恒指跌0.1% 腾讯控股(00700)早盘低开1.4% 友邦保险(01299)早盘高开1.02%领涨蓝筹
2021-08-16 09:23
庄东骐
港股开盘(8.12)︱恒指跌0.14% 联想集团(00992)早盘高开近5% 营收劲增27% 净利飙升119%
2021-08-12 09:23
庄东骐
港股开盘(8.11)︱恒指跌0.43% 阿里巴巴-SW(09988)早盘低开1.19% 拖累指数超30点
2021-08-11 09:24
庄东骐
高盛:更新医药股评级及目标价(表) 药明生物(02269)获列入“确信买入”名单
2021-08-09 15:32
刘家殷



 扫码下载智通APP
扫码下载智通APP