亚盛医药-B(06855):进入收获期
亚盛医药-B(06855)是全球唯一一家拥有靶向药物平台覆盖3条关键细胞凋亡通路的公司。
6月8日,亚盛在ASCO大会上进行了两项与细胞凋亡产品有关的口头报告:关于APG-2575在复发难治慢性淋巴细胞白血病(R/R CLL)和其他血液肿瘤患者中的安全性及疗效,以及APG-115联合帕博利珠单抗用于PD-1抑制剂治疗耐药的不可切除/转移性黑色素瘤或晚期实体瘤患者的II期临床研究初步结果。
APG-2575FIH研究ORR80%
具有best-in-class潜力
APG-2575属于Bcl-2抑制剂,该靶点药物由于设计难度大,历史上同类产品研发可谓九死一生,目前还处于活跃开发中的产品不超过10个。亚盛医药的APG-2575就是其中一员,此次公布的APG-2575首次人体试验(First in human,FIH)数据,也让其成为国内首个发布临床数据的Bcl-2抑制剂。
截至2021年4月15日,该研究共纳入36例受试者,在15例可评估的R/R CLL/SLL患者中,12例患者获得部分缓解(PR),客观缓解率(ORR)为80.0%;在另外21例其他血液肿瘤如多发性骨髓瘤(MM)患者中也看到初步疾病缓解迹象。

此外,针对复发难治的CLL患者,APG-2575无论在起效速度还是治疗深度上,都有较好的表现。
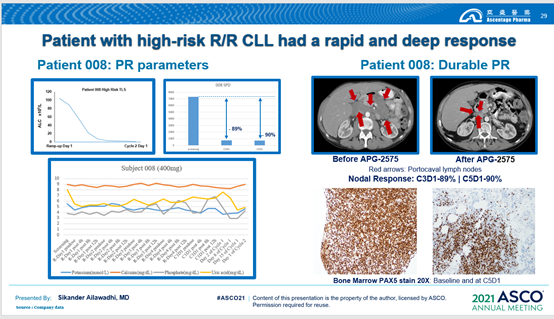
在安全性方面,数据显示APG-2575耐受性良好,治疗窗口广,不良事件可控。该产品的Ⅱ期推荐剂量是600mg,但研究中剂量递增至1200mg时仍未观察到剂量限制毒性(DLT)。而对于同靶点药物研究中曾出现的严重不良反应肿瘤细胞溶解综合征(TLS),在Ⅰ期研究中没有出现。

“这些令人印象深刻的疗效和安全性数据,使得APG-2575的Ⅰ期研究结果成功入选今年ASCO的口头报告,”亚盛医药董事长兼CEO杨大俊博士说,“在复发难治病人上能够获得ORR 80%这样的数据相当不易。作为全球第2个、中国首个进入临床阶段的Bcl-2选择性抑制剂,APG-2575的最新临床数据初步表现出良好的有效性和安全性,Best-in-Class潜力突出。”
此次研究还采用了对患者友好的剂量递增设计,患者从接受起始剂量治疗开始,每天进行一次剂量递增,用药5天就能达到目标剂量。
亚盛医药首席医学官翟一帆博士说:“以往类似药物的剂量递增方案采用的是每周递增一次,达到有效给药剂量需要5周时间,亚盛采用的这一设计以及研究的最终结果都证明了APG-2575的安全性。”
负责APG-2575研究的主要研究者(PI)、来自梅奥医学中心的Asher Chanan-Khan教授和Sikander Ailawadhi教授表示:“APG-2575的安全性是其对比同类药物一个明显的优势,对于TLS高风险的患者这可能是一个新的用药选择,同时其安全性还为研究继续提高用药剂量留下了较大的空间。”
MDM2-P53联用PD-1结果
有望打破IO耐药后临床困局
另一个入选ASCO口头报告的产品APG-115,其机制是干扰MDM2-P53的相互作用。目前全球还未有MDM2-P53相关产品获批上市,APG-115具有First-in-Class潜力。
今年3月,密歇根大学医学院邹伟平教授以及亚盛联合创始人之一王少萌教授等人在Nature immunology上发表的最新动物研究结果,提到MDM2蛋白可防止T细胞中的STAT5降解,有助于增强T细胞介导的抗肿瘤免疫,同时研究发现APG-115可以让T细胞中的MDM2呈剂量依赖性上调,并在使用APG-115的黑色素瘤和直肠癌等多种动物模型中看到肿瘤生长缓慢。
该项研究预示着APG-115的部分作用位点在T细胞上,提示其可能与PD-1抑制剂联用产生协同作用。而此次公布的APG-115与帕博利珠单抗联用的临床研究结果恰好呼应了此前的这一研究。
截至2021年4月15日,共有102例患者入组该II期研究。该研究一共分成6个队列,其中在黑色素瘤队列中,共有29例可评价患者,总体ORR为24%,疾病控制率(DCR)为 55.2%,同时联用方案对三种不同的黑色素瘤都显示出治疗效果。
在15例皮肤黑色素瘤患者中,有1例完全缓解(CR),3例部分缓解(PR);5例粘膜黑色素瘤患者2例PR;在目前尚未有效治疗手段的7例葡萄膜黑色素瘤中,也有14.3%(1例)ORR,另外 4例病人疾病稳定(SD),疾病控制率是71%(5/7)。

杨大俊说:“这次的研究能看到一个病人出现CR是很难得的,毕竟这些病人都是使用免疫治疗已经失败的病人。“事实上,在此前APG-115开展的单药Ⅰb期研究中,就有一个卵巢癌病人出现了CR,当时即引起同行对这一产品的关注。因为卵巢癌通常被认为是冷肿瘤,免疫疗法在其治疗上难以取得突破。
同时,此次的Ⅱ期研究结果,还继续验证了之前APG-115在恶性周围神经鞘膜瘤(MPNST)和脂肪肉瘤患者中观察到的良好抗肿瘤活性,6例MPNST患者中有1例PR。此外,在PD-1 / PD-L1抑制剂耐药的NSCLC (n=15)和尿路上皮癌 (n=8)队列中,也分别观察到1例PR 。

在安全性方面,APG-115联合帕博利珠单抗也是耐受性良好,研究中没有观察到叠加毒性。
APG-115联用帕博利珠单抗研究的PI,来自美国NEXT肿瘤治疗中心(NEXT Oncology)的创始人和CEO、美国德克萨斯州肿瘤治疗中心的临床研究主任Anthony W. Tolcher博士表示:“肿瘤免疫(IO)治疗耐药后的患者,目前还没有更好的治疗选择,而这一联用方案在IO治疗无效的多种适应症患者上都观察到治疗反应,未来我们会继续推动这一研究进行下去,希望获得更多的积极数据。”
APG-2575与APG-115“合成致死”
对T-PLL及其他血液肿瘤治疗意义重大
除上述研究外,杨大俊提到亚盛接下来的临床研究重心会放在APG-257和APG-115联用方案的开发上。
“APG-2575与APG-115联合能在多种癌症中激发‘合成致死’机制,即同时阻断肿瘤细胞借以逃避细胞凋亡的MDM2-TP53及Bcl-2两条关键通路,让肿瘤细胞无路可逃。”翟一帆说。
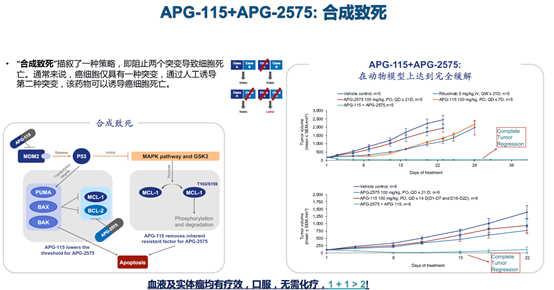
该联用方案的临床研究申请已于去年底前分别获得中国国家药监局药审中心(CDE)和美国FDA的许可,即将在两国同时开展用于复发/难治T-幼淋巴细胞白血病(R/R T-PLL)治疗的Ⅱa期临床研究。T-PLL侵袭性强,但十分罕见,发病率只有0.6/百万人,且尚没有任何药物在全球批准用于这一适应症治疗。而已有研究发现T-PLL病人的肿瘤很多是P53野生型,且有Bcl-2和MDM2激活,从机制上看,T-PLL患者很可能从研究中获益。
“这一研究对于T-PLL这一罕见肿瘤及其他血液肿瘤治疗具有极大的临床意义,所以CDE也很快就同意亚盛开展两个未上市新药联用的临床研究。”杨大俊强调,“这一方案的特点还在于两个产品都是口服靶向药,而亚盛也是唯一同时拥有这两个靶点在研药物的公司。”
亚盛还计划很快在中国及美国开展APG-2575的关键Ⅱ期注册临床研究,加快产品上市速度。
APG-2575目前正在开展或即将开展的临床研究已经达到13项,涉及急性髓细胞白血病(AML)、慢性淋巴细胞白血病(CLL)、华氏巨球蛋白血症(WM)、多发性骨髓瘤(MM) 及T-PLL 等多种血液瘤,同时还在积极探索实体瘤方面的适应症开发,目前实体瘤上还没有其他Bcl-2抑制剂公布研究数据。
据杨大俊介绍,APG-2575的开发策略是两条腿走路,一是让单药尽快上市,二是借助各种各样的联合用药方案拓展适应症,包括BTK、CD20、CD47等各靶点药物都在考虑之中。
全球首个获批上市的Bcl-2抑制剂维奈克拉已有4个适应症收获囊中,2020年全球销售额达13.37亿美元,另外还有超过270项临床研究正在进行。鉴于此,业界认为Bcl-2抑制剂未来有望成为小分子中的PD-1。
收获在即
随着产品线相关研究结果的不断发布,近两年亚盛也开始逐渐进入临床产品收获期。HQP1351已于去年向国家药监局递交上市申请,并被纳入优先审评和突破性治疗品种。同时其他品种的研究也在逐渐发布结果,并进入后期研发阶段。
今年亚盛还有两项研究入选ASCO壁报,分别是APG-115单药或联合铂类化疗治疗野生型唾液腺癌以及APG-1252(Bcl-2/Bcl-xL)联合紫杉醇治疗复发难治小细胞肺癌,这两个适应症目前临床上也还没有令人满意的治疗药物。很有意思的是,公司的三个细胞凋亡产品在一届的ASCO上全凑齐了。
杨大俊提到,未来公司产品开发的大方向仍然是关注临床未满足需求,公司至今共有4个在研新药获得11项FDA孤儿药资格认定,这恰恰反映出了亚盛在这方面的执着坚持。
本文选编自“研发客”,作者:施樱子,智通财经编辑:张金亮。



 扫码下载智通APP
扫码下载智通APP