19款药品纳入优先审评,来自辉瑞(PFE.US)、罗氏、百济神州(06160)、信达生物(01801)等十多家公司
本文来自“医药观澜”。
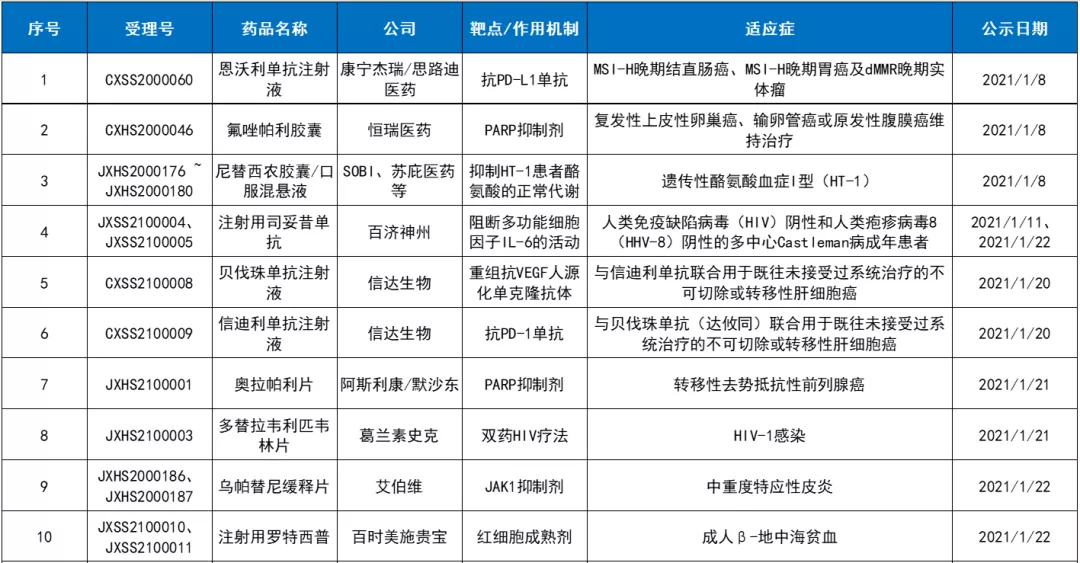
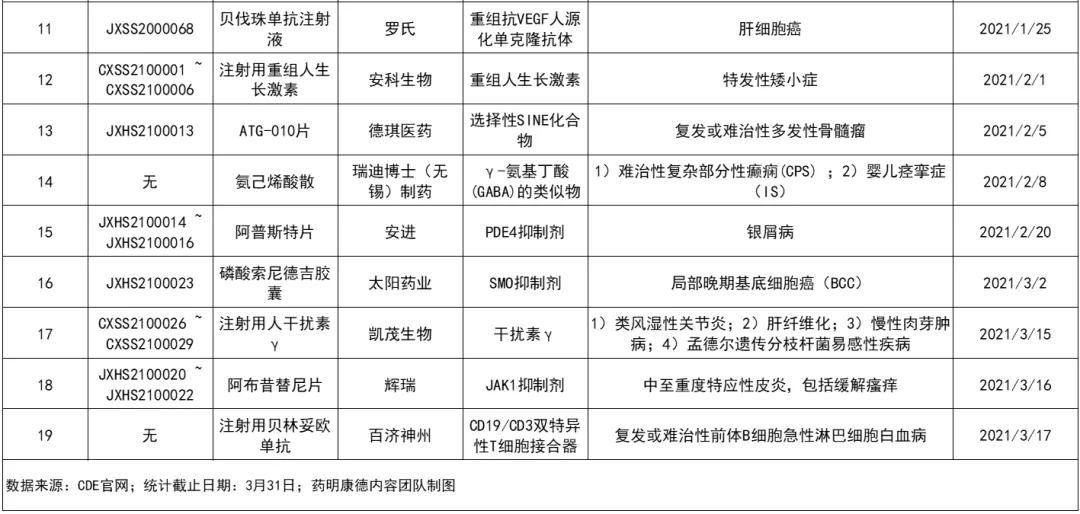
根据中国国家药监局(NMPA)药品审评中心(CDE)网站公示信息,截止3月31日,今年第一季度共计有38项(按受理号统计)申请被正式纳入优先审评,包括36项新药上市申请和2项无受理号的申请,涉及17家公司的19款药物。
从纳入优先审评理由来看,其中有5款为符合附条件批准的药品,4款为符合儿童生理特征的儿童用药品新品种、剂型和规格,2款为临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药。本文梳理这19款在今年第一季度纳入优先审评的药品,它们有望通过这一特殊审评通道在中国加速获批,惠及更多病患。
2021年第一季度纳入优先审评的药品
1、康宁杰瑞(09966)/思路迪医药:恩沃利单抗注射液
纳入理由:符合附条件批准的药品
恩沃利单抗(KN035)是一款可皮下注射的重组人源化PD-L1单域抗体Fc融合蛋白注射液。公开资料显示,恩沃利单抗本次纳入优先审评的上市申请由思路康瑞药业和康宁杰瑞联合申报,适应症为:既往接受过氟尿嘧啶类、奥沙利铂和伊立替康治疗的微卫星高度不稳定(MSI-H)晚期结直肠癌和既往至少一线标准治疗失败的MSI-H晚期胃癌及其他既往至少一线标准治疗失败的DNA错配修复功能缺陷(dMMR)晚期实体瘤。
根据2020年公布的一项2期关键临床数据,恩沃利单抗对MSI-H或dMMR晚期实体瘤展现出良好的疗效和安全性:BIRC评估的总体人群(n=103)客观缓解率(ORR)为42.7%,结直肠癌患者(n=65)ORR为43.1%,胃癌患者(n=18)ORR为44.4%,其他实体瘤患者(n=20)ORR为40.0%。各组12个月总生存期(OS)率依次分别为74.6%、72.9%、83.3%和75.0%。
2、恒瑞医药:氟唑帕利
纳入理由:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药
氟唑帕利是恒瑞医药研发的一种PARP抑制剂,可特异性杀伤BRCA突变的肿瘤细胞。该药已于2020年12月通过优先审评程序获得NMPA批准,用于既往经过二线及以上化疗的伴有胚系BRCA突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。此次纳入优先审评的新适应症为:用于铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌在含铂化疗达到完全缓解或部分缓解后的维持治疗。
根据恒瑞医药在2020年9月公布的数据,氟唑帕利在一项用于复发性卵巢癌维持治疗的3期临床研究(FZPL-III-301-OC)中达到主要研究终点。研究结果表明,氟唑帕利单药用于铂敏感的复发性卵巢癌、输卵管癌或原发性腹膜癌含铂治疗达到完全缓解或部分缓解后的维持治疗,可显著延长患者的无进展生存期。
3、SOBI、苏庇医药等:尼替西农胶囊/口服混悬液
纳入理由:符合《药品注册管理办法》和《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020年第82号)有关要求(下面简称:符合NMPA有关要求)
尼替西农(nitisinone)是由瑞典医药公司Swedish Orphan Biovitrum AB(SOBI)开发的一款治疗1型酪氨酸血症(HT-1)的药物,其胶囊剂和口服悬液剂已在美国和欧盟等多个地区获批上市。尼替西农可通过抑制HT-1患者酪氨酸的正常代谢,预防代谢中间体马来酰乙酰乙酸盐和延胡索酰乙酰乙酸盐的累积,防止肝肾毒性的发生。此次该产品在中国纳入优先审评,拟开发适应症为:结合酪氨酸和苯丙氨酸饮食限制,用于治疗成人和儿科患者(任何年龄阶段)的遗传性HT-1。
公开资料显示,尼替西农是国际上治疗HT-1的首选药物。HT-1由15号染色体基因缺陷导致,已在2018年被纳入中国《第一批罕见病目录》。大多数儿童病人在6个月前出现急性型病症,在1岁内表现出急性肝衰竭、反复出血和死亡危险较高等症状。亚急性型儿童在6~12个月内出现症状。目前,中国尚未有尼替西农产品上市,临床上存在明显的未被满足的临床需求。
4、百济神州(06160,BGNE.US):司妥昔单抗
纳入理由:NMPA规定其他优先审评审批的情形
司妥昔单抗(siltuximab)是一款单克隆抗体,用于阻断在多中心Castleman病患者中检测到升高的多功能细胞因子IL-6的活动。自2014年4月在美国首次获批以来,该产品已在全球40多个国家和地区获得批准用于治疗HIV呈阴性、人疱疹病毒-8(HHV-8)呈阴性的多中心型Castleman病患者。该适应症也是此次司妥昔单抗在中国纳入优先审评的适应症。同时,该产品还被列入中国《第一批临床急需境外新药》名单。
公开资料显示,司妥昔单抗最初由强生公司(Johnson & Johnson)研发,后授权给EUSA Pharma公司,百济神州于2020年1月获得该药物在大中华地区的独家开发和商业化权益。根据百济神州早前发布的新闻稿,司妥昔单抗已获得NMPA快速通道批准资格,符合临床急需境外新药的审评审批工作程序。
5、信达生物(01801):信迪利单抗联合贝伐珠单抗
纳入理由:符合NMPA有关要求
信迪利单抗(达伯舒)是信达生物和礼来公司(Eli Lilly and Company)共同开发的一款创新PD-1单克隆抗体,已在中国获批用于治疗复发/难治性经典型霍奇金淋巴瘤和一线治疗非鳞状非小细胞肺癌(NSCLC)。贝伐珠单抗(达攸同)是一款重组抗VEGF人源化单克隆抗体,已在中国获批用于治疗晚期非小细胞肺癌、转移性结直肠和成人复发性胶质母细胞瘤等。
根据CDE公示,此次纳入优先审评的是信迪利单抗与达攸同联合疗法的新适应症上市申请,用于既往未接受过系统治疗的不可切除或转移性肝细胞癌。该申请主要基于ORIENT-32研究的结果。期中分析显示,对比索拉非尼单药治疗,联合治疗组死亡风险下降43.1%,中位OS尚未达到(vs 10.4个月)。联合治疗组疾病进展风险下降43.5%,中位无进展生存期(PFS)为4.6个月(vs 2.8个月)。
6、阿斯利康(AZN.US)/默沙东(MRK.US):奥拉帕利
纳入理由:符合附条件批准的药品
奥拉帕利(olaparib)是阿斯利康和默沙东联合开发的一款“first-in-class”PARP抑制剂,也是首个获批的PARP抑制剂。该药靶向DNA损伤修复反应(DDR)通路,利用“合成致死“原理,在杀伤癌细胞的同时,不影响健康细胞。奥拉帕利是首个在中国获批上市的卵巢癌靶向新药,可用于携带BRCA基因突变的晚期卵巢癌患者的一线维持治疗。
此次奥拉帕利在中国纳入优先审评,拟用于携带BRCA1/2突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌(mCRPC)成人患者的单药治疗。根据一项名为PROfound的3期临床试验结果,在携带BRCA1/2或ATM基因突变(HRR基因突变亚群)的转移性去势抵抗性前列腺癌患者中,奥拉帕利与对照药相比可使患者的OS得到显著的改善。此前公布的试验结果显示,在携带BRCA1/2或ATM突变的mCRPC患者中,奥拉帕利的治疗使患者的放射学无进展生存期(rPFS)显著延长。
7、葛兰素史克(GSK.US):多替拉韦利匹韦林片
纳入理由:NMPA规定其他优先审评审批的情形
多替拉韦利匹韦林(dolutegravir and rilpivirine)是由GSK旗下ViiV Healthcare公司推出的一款双药HIV疗法。该药已于2017年11月在美国获批上市,治疗感染人类免疫缺陷病毒1型(HIV-1)的特定成人患者,是首款获批治疗感染HIV-1患者的双药疗法。其中,多替拉韦是一款HIV-1整合酶链转移抑制剂(INSTI),利匹韦林是一款非核苷逆转录酶抑制剂(NNRTI)。
此次多替拉韦利匹韦林在中国纳入优先审评,适应症为:用于治疗接受稳定的抗逆转录病毒治疗方案达到病毒学抑制(HIV-1 RNA小于50拷贝/mL)至少六个月,无病毒学失败史,且对非核苷类逆转录酶抑制剂或整合酶抑制剂没有已知或疑似耐药性的成人HIV-1感染患者。两项名为SWORD 1和SWORD 2的研究表明,多替拉韦利匹韦林能有效抑制HIV病毒,效果与这些志愿者曾使用的抗HIV疗法相当。具体的,与三药或四药方案相比,多替拉韦利匹韦林方案在48周时实现了非劣效的病毒抑制,治疗组之间的抑制率相似。
8、艾伯维(ABBV.US):乌帕替尼缓释片
纳入理由:符合儿童生理特征的儿童用药品新品种、剂型和规格
乌帕替尼(upadacitinib)由艾伯维科学家发现和开发,是一种每日口服一次,选择性和可逆性JAK1抑制剂,曾获FDA突破性疗法认定。JAK1在免疫介导的疾病的病理生理过程中发挥重要作用。2019年8月,乌帕替尼获得美国FDA批准,治疗对甲氨蝶呤反应不足或不耐受的中重度活动性类风湿关节炎成人患者。
此次乌帕替尼在中国纳入优先审评,拟开发适应症为:用于适合系统性治疗的成人和12岁及12岁以上青少年中重度特应性皮炎患者。此前,乌帕替尼已于2020年先后在三项(Measure up 1,AD Up,Heads up)治疗中重度特应性皮炎患者的3期临床试验中取得积极结果,显示了乌帕替尼对特应性皮炎患者的潜在治疗作用,可显著降低患者皮肤症状,并在瘙痒和皮肤清除等方面有较好的疗效。
9、百时美施贵宝(BMY.US):注射用罗特西普
纳入理由:符合附条件批准的药品
注射用罗特西普(luspatercept)是BMS旗下新基(Celgene)公司的一款“first-in-class”红细胞成熟剂。作为一种重组融合蛋白类药物,该药通过促进晚期红细胞的成熟,提高血红蛋白水平。它的全新机制将有望降低患者对输血及祛铁治疗的依赖,提高治疗依从性,同时还能规避反复输血引起的潜在风险。
据介绍,本次罗特西普用于需要定期输注红细胞(RBC)的成人β-地中海贫血患者的上市申请在中国纳入优先审评,是基于一项名为BELIEVE的随机、双盲、安慰剂对照、多中心的全球3期临床试验结果。数据显示,罗特西普+最佳支持治疗(BSC)对比安慰剂+BSC用于需要定期输注红细胞的成人β地中海贫血患者,21.4%的患者的输血负担与基线相比降低超过33%,显著优于安慰剂组(4.5%),且患者铁过载显著降低,由此可能改善患者生活质量。
10、罗氏(Roche):贝伐珠单抗注射液
纳入理由:NMPA规定其他优先审评审批的情形
罗氏的贝伐珠单抗(bevacizumab,安维汀)是一种人源化单克隆抗体IgG1,属血管内皮生长因子(VEGF)抑制剂。它通过与VEGF蛋白特异性结合,抑制VEGF与其受体(VEGFR)结合,阻断血管生成的信号传导途径,抑制肿瘤细胞生长。此次该药在中国纳入优先审评的适应症为:贝伐珠单抗联合阿替利珠单抗(下称“T+A”方案)治疗既往未接受过全身系统性治疗的不可切除肝细胞癌(HCC)患者。
根据罗氏在今年1月公布的IMbrave150研究数据,这是一项全球性2期、多中心、开放性研究,旨在评估“T+A”方案对比索拉非尼在既往未接受过系统性治疗的不可切除肝细胞癌患者中的作用。最新分析结果表明,“T+A”方案可降低死亡风险34%,中位OS达到19.2个月,优于此前标准方案的13.4个月;在中国亚群中,中位OS达到了24.0个月,优于此前标准方案的11.4个月。
11、安科生物:注射用重组人生长激素
纳入理由:符合儿童生理特征的儿童用药品新品种、剂型和规格
生长激素(GH)是由人体脑垂体前叶分泌的一种肽类激素,能促进骨骼、内脏和全身生长。根据安科生物今年2月发布的公告,其注射用重组人生长激素已获批上市6个适应症:1)用于因内源性生长激素缺乏所引起的儿童生长缓慢;2)用于因Noonan综合征所引起的儿童身材矮小;3)用于因SHOX基因缺陷所引起的儿童身材矮小或生长障碍;4)用于重度烧伤治疗;5)用于因软骨发育不全所引起的儿童身材矮小;6)用于接受营养支持的成人短肠综合症。
公告显示,本次纳入优先审评的特发性矮小(ISS)新适应症,是对已获批适应症的丰富和补充。ISS是指无全身性、内分泌、营养性疾病或染色体异常的身材矮小,可由多种目前尚不明确的病因引起。这种疾病不仅给患儿身心健康、人际交往、社会就业等带来严重危害,也给社会带来沉重的负担。据统计,中国儿童矮身材发生率为3%左右,而特发性矮小是儿童身材矮小中最常见的类型。
12、德琪医药(06996):ATG-010
纳入理由:符合附条件批准的药品
ATG-010(selinexor)是由Karyopharm Therapeutics研发的一款“first-in-class”口服型选择性SINE化合物,德琪医药拥有该药在包括大中华区、韩国、澳大利亚、新西兰和东盟国家的多个亚太市场的独家开发和商业化权利。研究表明,ATG-010可以引起肿瘤抑制蛋白和其他生长调节蛋白的核内储留和活化,以及下调细胞浆内多种致癌蛋白水平,并在体外和体内诱导大量实体和血液肿瘤细胞的凋亡,而正常细胞不受影响。
在美国,ATG-010已获FDA批准治疗多种适应症,涵盖多发性骨髓瘤和弥漫性大B细胞淋巴瘤。此次该产品在中国纳入优先审评,拟用于与地塞米松联用,治疗既往接受过治疗且对至少一种蛋白酶体抑制剂,一种免疫调节剂以及一种抗CD38单抗难治的复发或难治性多发性骨髓瘤。ATG-010在美国获批时的数据显示,ATG-010与地塞米松联用在治疗83名复发/难治性多发性骨髓瘤患者中取得了良好的疗效:在这些高度难治的患者中,组合疗法达到25.3%的总缓解率,缓解持续时间为3.8个月。
13、瑞迪博士(无锡)制药:氨己烯酸散
纳入理由:符合儿童生理特征的儿童用药品新品种、剂型和规格
氨己烯酸散为γ-氨基丁酸(GABA)的类似物,是FDA批准的极少数治疗婴儿痉挛和使用多种癫痫疗法之后仍不能控制发作的部分成人复杂部分性癫痫发作的有效药物之一。据悉,该药的作用机理是,能特异性地与GABA氨基转移酶结合且不可逆转,导致脑内GABA浓度增高,从而发挥抗癫痫作用。
根据CDE公示,此次纳入优先审评的氨己烯酸散拟定适应症包括:1)作为辅助药物治疗成人和2岁及以上患儿的难治性复杂部分发作癫痫(CPS),此类患者已对若干替代治疗的疗效不佳,且此类患者中药物的潜在获益应大于视觉丧失的潜在风险;2)作为单一药物治疗1月至2周岁患儿的婴儿痉挛症(IS),此类患者中药物的潜在获益应大于视觉丧失的潜在风险。
14、安进(AMGN.US):阿普斯特片
纳入理由:符合NMPA有关要求
阿普斯特(apremilast)是一种新型的口服小分子磷酸二酯酶4(PDE4)抑制剂,通过剂量依赖性抑制人类滑膜细胞释放肿瘤坏死因子(TNF)-α而发挥作用。该产品最初由BMS旗下新基公司研发,安进于2019年8月宣布以高达134亿美元收购获得了阿普斯特全球权益。目前,阿普斯特已在美国获批的适应症有中度至重度斑块型银屑病、活动性银屑病关节炎及与白塞病相关口腔溃疡等。
此次阿普斯特在中国纳入优先审评,拟定适应症为银屑病。在一项名为ADVANCE的多中心、随机、含安慰剂对照组的3期临床研究中,阿普斯特治疗轻中度斑块状银屑病患者达到了主要终点,在第16周的静态医生总体评估(sPGA)中使患者的皮肤状况达到了统计学意义上的显著改善。另一项名为ESTEEM 1的研究结果显示,与安慰剂相比,接受阿普斯特预防治疗的患者银屑病面积和严重程度指数改善75%(PASI-75)的患者,在16周时明显多于安慰剂(33.1% vs 5.3%)。
15、太阳药业(Sun Pharma):磷酸索尼德吉胶囊
纳入理由:NMPA规定其他优先审评审批的情形
磷酸索尼德吉(sonidegib phosphate)是诺华(Novartis)研发的一种口服选择性Smoothened(SMO)抑制剂,太阳药业于2016年12月宣布以1.75亿美元从诺华获得该药全球权益。SMO是一种7次跨膜蛋白,调控Hedgehog(Hh)信号通路,该通路在干细胞维持、组织修复、晚期基底细胞癌中发挥关键作用。2015年,磷酸索尼德吉获得美国FDA加速批准用于局部晚期基底细胞癌(BCC)患者。
此次索尼德吉在中国纳入优先审评,适用于手术或放疗后复发的局部晚期基底细胞癌的成年患者,或不宜手术或放疗的患者。根据一项名为BOLT的国际多中心、随机、双盲2期研究,该研究在不适合局部治疗的局部晚期基底细胞癌或转移性基底细胞癌成人患者中开展,评估了磷酸索尼德吉的疗效和安全性。经中心审查委员会评定的数据显示,磷酸索尼德吉200mg剂量组ORR为58%,其中完全缓解率(CR)为5%,部分缓解率(PR)为53%。
16、凯茂生物:注射用人干扰素γ
纳入理由:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药
干扰素γ具有较强的免疫调节功能,能增强抗原递呈细胞功能,加快免疫复合物的清除和提高吞噬异物功能,对淋巴细胞具有双向调节功能,提高抗体依赖的细胞毒反应,增强某些免疫活性细胞HLA—Ⅱ类抗原表达。根据NMPA官网资料,目前中国仅有凯茂生物一家的注射用人干扰素γ获批上市。
根据CDE公示,此次凯茂生物注射用人干扰素γ纳入优先审评,纳入优先审评的理由为:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药,拟定适应症包括:1)类风湿性关节炎;2)肝纤维化;3)慢性肉芽肿病;4)孟德尔遗传分枝杆菌易感性疾病。
17、辉瑞(PFE.US):阿布昔替尼片
纳入理由:符合儿童生理特征的儿童用药品新品种、剂型和规格
阿布昔替尼(abrocitinib)是一款口服JAK1抑制剂,可选择性抑制JAK1,对JAK1的抑制被认为可调节参与特应性皮炎病理过程的多种细胞因子。2020年10月,辉瑞宣布FDA接受了abrocitinib的新药上市申请,用于治疗12岁以上中重度特应性皮炎患者,并授予其优先审评资格。此前,该药还被FDA授予突破性疗法认定。
此次abrocitinib在中国纳入优先审评,适应症为:联合或不联合外用疗法,治疗对外用治疗反应不佳或不适合这些治疗的12岁及以上中至重度特应性皮炎患者,包括缓解瘙痒。多项3期临床试验结果显示,abrocitinib在皮肤症状清除率、疾病严重程度方面显示出统计学显著改善,能快速改善特应性皮炎患者的瘙痒症状。例如,在名为JADE MONO-1的3期临床中,接受治疗12周后,200mg和100mg治疗组分别有43.8%和23.7%的患者皮肤症状达到或接近完全消失,而安慰剂组的数值为7.9%。此外,这两个治疗组分别有62.7%和39.7%患者的湿疹面积和严重程度指数比基线改变至少75%,而安慰剂组中这一数值仅有11.8%。
18、百济神州:注射用贝林妥欧单抗
纳入理由:符合附条件批准的药品
贝林妥欧单抗(blinatumomab)是安进开发的一款靶向CD19和CD3的双特异性T细胞接合器(BiTE),百济神州于2019年通过与安进合作获得了该药在中国的商业化权益。作为一款BiTE分子,贝林妥欧单抗的一端可与B细胞表面表达的CD19抗原相结合,另一端与T细胞表面的CD3受体相结合。它能够将T细胞募集到癌细胞附近,促进它们对癌细胞的杀伤。此前,该药已在美国获批用于前体B细胞急性淋巴细胞白血病(ALL)。
此次贝林妥欧单抗在中国纳入优先审评,适应症为:用于治疗成人及儿童复发或难治性前体B细胞急性淋巴细胞白血病。根据一项发表在《美国医学会杂志》(JAMA)上的3期临床试验数据,贝林妥欧单抗治疗高危首次复发B细胞ALL儿童患者疗效显著。在中位随访时间为22.4个月时,治疗组有69%患者维持无事件生存(vs 43%);在基线时微小残留病(MRD)阳性患者中,治疗组有93%达到MRD阴性缓解(vs 24%);此外,治疗组患者36个月时的总生存率估计为81.1%,高于化疗组的55.8%。
(智通财经编辑:庄礼佳)



 扫码下载智通APP
扫码下载智通APP