5款新药拟纳入优先审评,阿斯利康(AZN.US)及赛诺菲(SNY.US)等产品在列!
本文来自微信号“医药观澜”。
10月12日,中国国家药监局药品审评中心(CDE)网站公示,5款新药上市申请拟纳入优先审评(详见下表)。这些产品分别是贝达药业1类新药埃克替尼,阿斯利康(AZN.US)EGFR-TKI奥希替尼,泽璟制药肝癌新药多纳非尼,拜耳(Bayer)抗血栓产品利伐沙班,赛诺菲(SNY.US)"双靶点"抗体度普利尤单抗(dupilumab)。
拟纳入优先审评的5款新药
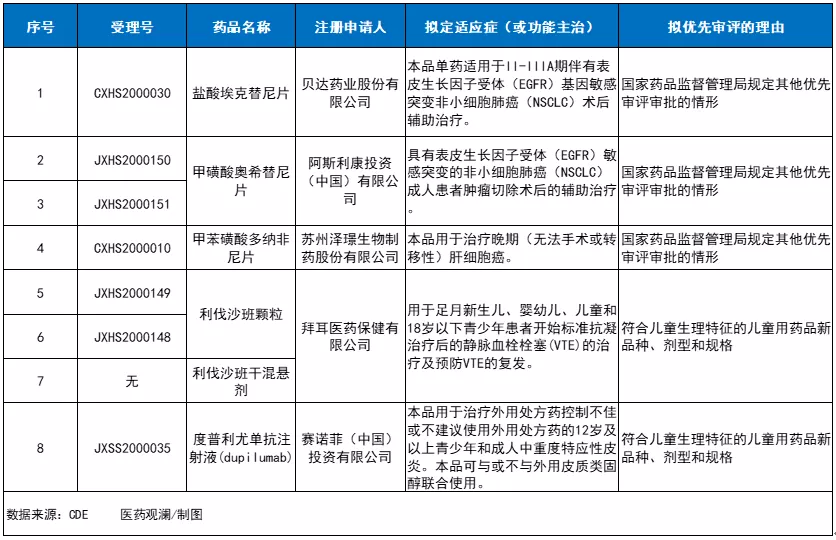
1、贝达药业:盐酸埃克替尼片
靶点/作用机制:表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)
埃克替尼是贝达药业历时近十年自主研发的一种强效、高选择性的口服EGFR-TKI,属于1类创新药。EGFR-TKI能特异、竞争性地结合EGFR激酶功能区的ATP结合位点,抑制其激酶活性从而阻断癌细胞增殖、转移等相关信号的传导。2011年,该产品在中国获批上市,用于非小细胞肺癌(NSCLC)的二/三线治疗。2014年,埃克替尼再次获批,单药适用于治疗EGFR基因具有敏感突变的局部晚期或转移性NSCLC患者的一线治疗。
此次埃克替尼新上市申请拟纳入优先审评,适应症为:单药用于II-IIIA期伴有EGFR基因敏感突变NSCLC术后辅助治疗。在一项名为EVIDENCE的研究中,埃克替尼用于EGFR基因敏感突变的NSCLC患者术后辅助治疗的疗效优于标准辅助化疗,能显著延长患者无病生存期,同时安全性更优。
2、阿斯利康:甲磺酸奥希替尼片
靶点/作用机制:EGFR-TKI
奥希替尼(泰瑞沙,AZD9291)是阿斯利康开发的一种不可逆、第三代EGFR-TKI,可同时抑制EGFR敏感突变和EGFR-T790M耐药突变,并对中枢神经系统转移病灶有临床疗效。在中国,该产品已获批用于EGFR突变阳性的晚期NSCLC患者的一线治疗,以及EGFR-T790M突变阳性的晚期NSCLC患者的二线治疗。并且,它还被纳入中国国家医保目录。
此次奥希替尼新适应症拟纳入优先审评,拟开发用于具有EGFR敏感突变的NSCLC成人患者肿瘤切除术后的辅助治疗。值得一提的是,该适应症在美国已被FDA授予突破性疗法认定。这主要基于奥希替尼3期临床试验ADAURA的优异结果,在这项试验中,奥希替尼使疾病复发或死亡风险降低约80%。
3、泽璟制药:甲苯磺酸多纳非尼片
靶点/作用机制:多靶点、多激酶抑制剂
多纳非尼是泽璟制药开发的口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,属于1类新药。研究表明,该药既可抑制VEGFR、PDGFR等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶,并抑制下游的Raf/MEK/ERK信号传导通路,具有多重抑制、多靶点阻断的抗肿瘤作用。此前,多纳非尼已被中国临床肿瘤学会(CSCO)发布的2020年版《原发性肝癌诊疗指南》列为晚期肝细胞癌一线治疗药物,并且是I级专家推荐和1A类证据。
此次多纳非尼上市申请拟纳入优先审评,拟开发用于治疗晚期(无法手术或转移性)肝细胞癌。根据一项名为ZGDH3的多中心2/3期临床研究,在未接受过系统治疗的不可手术或转移性晚期肝细胞癌患者中,多纳非尼治疗组的中位总生存期(mOS)显著优于对照组。
4、拜耳:利伐沙班颗粒/干混悬剂
靶点/作用机制:Xa因子抑制剂
利伐沙班(拜瑞妥)是拜耳一款口服,具有生物利用度的Xa因子抑制剂,其选择性地阻断Xa因子的活性位点,且不需要辅因子(例如抗凝血酶Ⅲ)以发挥活性。在中国,该产品的片剂剂型已被批准用于预防和治疗成人静脉血栓(VTE),以及用于具有一种或多种危险因素如高血压的非瓣膜性房颤成年患者,以降低卒中和全身性栓塞的风险。
此次是利伐沙班颗粒剂和干混悬剂这两种剂型的上市申请在中国拟纳入优先审评,理由为符合儿童生理特征的儿童用药品新品种、剂型和规格。根据CDE公示,新适应症为:用于足月新生儿、婴幼儿、儿童和18岁以下青少年患者开始标准抗凝治疗后的VTE的治疗及预防VTE的复发。
5、赛诺菲:度普利尤单抗注射液
靶点/作用机制:IL-4和IL-13“双靶点”抗体
度普利尤单抗是赛诺菲和再生元(Regeneron)联合开发的一款全人单克隆抗体,能够通过“双靶点”的创新作用机制,选择性地抑制关键信号通路白介素4(IL-4)和白介素13(IL-13),阻断2型炎症通路,降低2型炎症的病理性反应,从机制上治疗2型炎症相关疾病。根据赛诺菲早前发布的新闻稿,该药是FDA批准的首个IL-4Rα抗体和首个用于中重度特应性皮炎的生物制品。
在中国,度普利尤单抗是临床急需境外新药之一,已于今年6月获批用于治疗成人中重度特应性皮炎。此次度普利尤单抗新适应症上市申请以符合儿童生理特征的儿童用药品新品种、剂型和规格的理由拟纳入优先审评,拟开发用于治疗外用处方药控制不佳或不建议使用外用处方药的12岁及以上青少年和成人中重度特应性皮炎。
(编辑:mz)



 扫码下载智通APP
扫码下载智通APP