OK药之下,君实(01877)、信达(01801)、百济(06160)、恒瑞的群雄逐鹿
本文来源微信公众号“ MedTrend医趋势”。
就在业界还在等待O药今年5月20日通过组合治疗重新回到中国肺癌市场时,3月28日,K药以迅雷不及掩耳之势在中国获批肺癌一线治疗,强势占领市场!
商业竞争中对手不会停下脚步!即使是如此残酷的PD-1市场,各大药企还是紧随其后入局PD-1市场,希望能在破晓前分一杯羹。
国产PD-1陆续入局
继BMS和默沙东(MRK.US)之后,国产创新药物在PD-1领域刮起了一阵中国旋风。无怪乎美国著名的生物技术分析师,Endpoints News主编John Carroll发出这样的感叹“君实正在港股发起一轮巨大的IPO,因为他们有PD-1。感觉每个人都应该有PD-1。我也觉得我应该在车库里有一个PD-1, 这样我可以说,这是我的卡车,摩托雪橇和PD-1。”
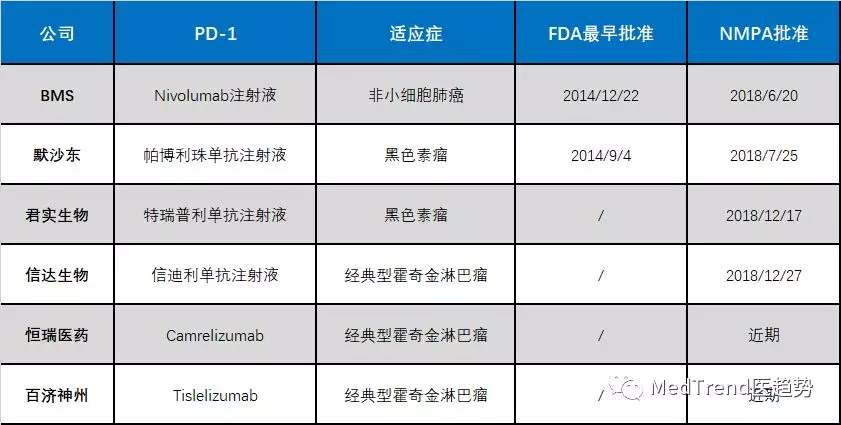
▲PD-1药物中国上市详情
2018年4月起,君实生物(01877)、信达生物(01801)、恒瑞医药、百济神州(06160)先后向国家药品监督管理局递交了旗下PD-1单抗的上市申请。
2018年12月17日,NMPA批准首个国产PD-1单抗——君实生物的特瑞普利单抗注射液(商品名:拓益)上市。这是中国企业独立研发,具有完全自主知识产权的生物制品创新药品,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。
2018年12月27日,拓益获批后仅仅十天,信达生物的PD-1单抗——信迪利单抗(商品名:达伯舒)正式被国家药品监督管理局批准上市,该药由信达生物和礼来药业共同开发,用于至少经过二线系统化疗的复发性或难治性经典型霍奇金淋巴瘤的治疗。
今年1月中旬的业内消息,恒瑞医药旗下PD-1单抗——卡瑞利珠单抗已经完成国内审批,处于制证阶段,恒瑞也信心满满于策划了1月19日卡瑞利珠单抗上海上市会。然而,NMPA的审批通知却未能如约而至,上市会变成了信息交流会。
截至目前,恒瑞制药的卡瑞利珠单抗历经四次补充。相关投资业界估计,如果该药能在4月初获批上市,还可以赶上新一轮抗癌药谈判进医保!
而百济神州追赶的脚步就在恒瑞身后不远处,仅仅略晚数月。
在可预见的2018和2019年,这四款国产PD-1单抗药物都将获批上市。
群雄逐鹿
作为2018年的诺贝生理学与医学获奖成果,PD-1肿瘤免疫是这几年生物医药创新药领域最大的热门。BMS和MSD已经占得先机,旗下的PD-1药物Opdivo(O药)和Keytruda(K药)相继在NMPA获批,面对国内企业的竞争,主动下调了O药和K药在国内的销售价格至全球最低。

就在2019年3月28日,K药在中国获得非小细胞肺癌一线适应症,投身肺癌这块癌症发生最大的领域。O药则把目光转到肺癌以外,加速它在其他肿瘤的适应症审批。另外两款PD-L1药物,罗氏的Tecentriq(T药)和阿斯利康的Imfinzi(I药),已经在进行NMPA的注册递交,预计2019年也将获批上市。

根据君实生物港交所披露的招股书显示,预计2022年中国PD-1和PD-L1抑制剂的市场规模将达到374亿元,到2030年会达到984亿元。如此巨大的肿瘤免疫市场,入局的国内药企和境外制药巨头都会有所斩获。
国内PD-1/PD-L1参与的玩家远远不止4家。面对激烈的市场竞争,谁能脱颖而出,成为最后的赢家?
考虑到第二梯队和第三梯队不占优势,本文只谈讨第一梯队四家企业,君实、信达、恒瑞、百济。随着2018~2019这四家企业的PD-1创新药物获批上市,获取更多的资源和关注,剩下的第二梯队和第三梯队PD-1研发企业将面临资本的寒冬。
以下,我们将从适应症、定价、安全性等多个角度比较这四款PD-1创新药。
从适应症来看
关键适应症扩展:恒瑞、百济> 信达 > 君实
君实生物和信达生物旗下PD-1药物首次获批分别为黑色素瘤和难治性/复发性经典型霍奇金淋巴瘤,这两种癌症都不常见,在全国恶性肿瘤发病排名末尾,发病率占全部肿瘤1%都不到。恒瑞和百济首次申报的适应症也是经典型霍奇金淋巴瘤。
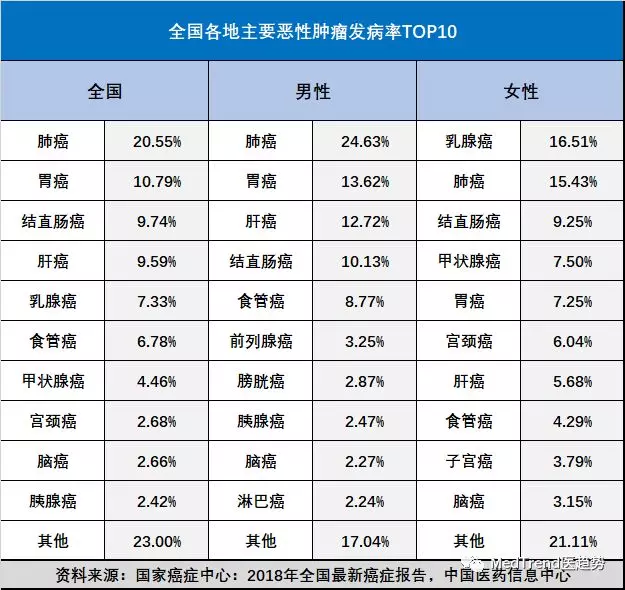
由此来看,国内PD-1第一梯队4家企业都采用相同策略,先通过罕见恶性肿瘤先获批上市,上市以后再进一步扩大适应症。
第一梯队四家企业的PD-1扩大适应症,依赖于目前进展中的临床试验进展,目前处于3期临床的适应症,才有可能在2019年进行注册递交。
以下是第一梯队已经进展到3期的临床试验情况:
君实生物拓益:3期临床鼻咽癌,膀胱癌和非小细胞肺癌还处于2期临床。
信达生物达伯舒:3期临床非小细胞肺癌,食管癌等处于2期临床。
恒瑞医药Camrelizumab:3期临床非小细胞肺癌、食管癌、肝细胞癌。
百济神州Tislelizumab:3期临床非小细胞肺癌、食管癌、肝细胞癌。
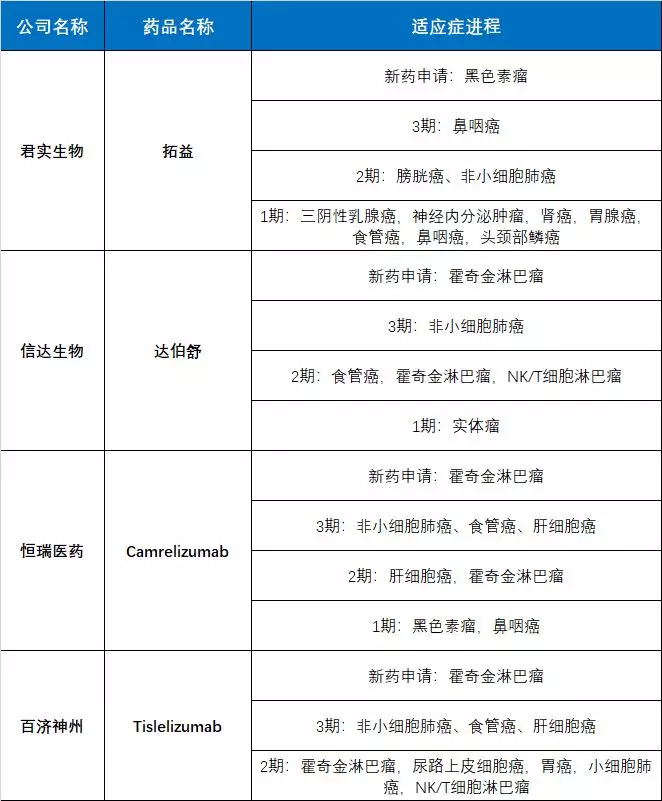
▲国产PD-1第一梯队临床进度
从适应症后续扩展来看,第一梯队中,虽然君实和信达先拿到上市审批,但是对于发病率高的恶性肿瘤,非小细胞肺癌、食管癌、肝细胞癌,恒瑞和百济反而会更早拿到扩展适应症审批。
从定价来看
第一梯队4家企业的定价排名:君实 > 信达>恒瑞> 百济

▲中国上市PD-1药物价格
考虑到中国PD-1市场的激烈竞争,BMS的O药和MSD的K药,主动下调在国内的销售价格至全球最低。
K药在O药的基础上进一步降价,而国内首个上市的拓益,更是在K药基础上进一步降价三分之一。正所谓一山还比一山高,一药更比一药低。拓益已经把PD-1每年治疗费用降到了18.7万元。这让排在身后的信达、恒瑞、百济情何以堪。
虽然百济神州的CEO吴晓滨多次表示,在PD-1上,只打价格战永远没有出息。但是,PD-1现实中的价格战已经打响了。对于后进者来说,PD-1很难参考O药和K药每年30多万的治疗费用,很有可能直线跳水到20万元左右。
从定价来看,后进者承受的定价压力远大于先行者。
从安全性来看
从安全性来看,第一梯队4家排名如下:百济 > 恒瑞> 信达> 君实
药物的安全性与疗效一样不可或缺。药品安全性需要考虑各制药公司生产单克隆抗体的既往经验,是否能够筛选适合的患者参与治疗,有没有健全的质量体系、药物警戒,应对可能发生的不良事件。
国内第一梯队4家企业与境外4巨头相比,最大的不足在于生物制药经验。境外4巨头,BMS, MSD, Roche, AZ,各自都在生物制药领域积累了多年的经验,工艺水平成熟,而且国外已批准上市的几款药物,都借鉴了伴随诊断的理念。
比如
默沙东的Keytruda用于非小细胞肺癌一线治疗需要参考Dako PD-L1抗体22c3的表达情况;
BMS的Opdivo用于治疗需要参考Dako PD-L1抗体28-8的表达作为补充诊断;
罗氏的Tecentriq用于治疗需要参考Ventana PD-L1抗体 sp142的表达;
阿斯利康的Imfinzi用于治疗需要参考Ventana PD-L1抗体sp263的表达。
PD-L1表达量越高,相应采用PD-1/PD-L1抑制剂治疗越有效。考虑到不同的PD-1/PD-L1抑制剂,需要检测不同的PD-L1抗体,FDA近期开展了蓝印计划,比较不同抗体检测结果的标准化和一致性。初步的标准化结果,专家认为22c3,28-8,sp263,这三个克隆号的PD-L1抗体结果一致性较高。
对应到第一梯队4家企业,无论是钱多的恒瑞、百济,还是钱少的君实、信达,都没有发布过PD-1各自适合的抗体作为伴随诊断。后续临床实践,如何筛选到合适的患者,避免将其用于不适合的肿瘤患者,将成为巨大的挑战。
更为重要的,第一梯队4家企业中只有恒瑞是传统的生物医药公司,拥有过单克隆抗体从研发到上市的全部过程。其他3家企业,都是当下资本与科技相融合的新型公司,他们在患者筛选、质量体系、药物警戒等领域还要经受考验。
其中信达生物和百济神州的产品,国内公司处于自身抗体生产的短板,分别与礼来和勃林格殷格翰进行了合作开发。其中百济更是直接借鉴了勃林格殷格翰的力量进行替雷利珠单抗(Tislelizumab)的工艺开发和药品生产服务。
恒瑞医药的卡瑞丽珠单抗,虽然也属于人源化抗PD-1抗体,但是前期临床试验发现血管瘤副反应发生率比较高,在淋巴瘤患者中达到了79.3%,其它国内外药厂例如BMS、MSD、信达、百济的PD-1临床研究尚未报告有类似的不良反应出现。
另有报道,联合用药时,不会出现血管瘤副反应。将卡瑞丽珠单抗与甲磺酸阿帕替尼联合用药是恒瑞下一步的方向。
PD-1群雄纷争,华山论剑,谁能笑到最后。从短期来看,上市时间越早越有优势;从中期来看,市场策略的作用巨大;从长期来看,药效将最终决定归属。通过前面的比较,相信读者心中已经有答案了。(编辑:刘瑞)



 扫码下载智通APP
扫码下载智通APP