春风吹,战鼓擂,港股仿制药企怕过谁?
2018年,港股时常在喊是“独角兽”选秀年,是生物医药“元年”,可在智通财经APP看来,2018年同样是仿制药“生死”年,因为按要求,289种化学药品仿制药口服固体制剂品种及其相应的规格需在今年年底完成一致性评价工作,否则,相关企业将“自动”会失去招标资格,最丢掉医保市场。
时间紧迫,仿制药需求量大,4月3日,国务院办公厅再次印发《关于改革完善仿制药供应保障及使用政策的意见》,明确提出,促进仿制药替代使用,将与原研药质量和疗效一致的仿制药纳入与原研药可相互替代药品目录。
利好政策一出,瞬间打爆A、H股医药主体板块,相关概念股驱动明显。以港股为例,截至4月4日午盘,包括李氏大药厂(00950)、上海医药(02607)、复星医药(02196)、石药集团(01093)、中国生物制药(01177)、绿叶制药(02186)、东阳光药(01558)、药明生物(02269)等多只票实现4-10个点以上的涨幅。
行情来源:富途证券
政策让医药板块走强,那就究竟如何在众多票中甄选到一只心仪的红利票?这一切仍旧得从仿制药一致性评价说起。
仿制药企再迎一波利好
闲话少说,关于《关于改革完善仿制药供应保障及使用政策的意见》,智通财经APP认为,注意三个重点即可:
一是要促进仿制药研发,重点解决高质量仿制药紧缺问题。
简单理解就是定期制定并公布鼓励仿制的药品目录,引导企业研发、注册和生产;加强仿制药技术攻关,将鼓励仿制药品的关键共性技术研究列入国家相关科技计划;研究完善与我国经济社会发展水平和产业发展阶段相适应的药品知识产权保护制度,充分平衡药品专利权人与社会公众的利益。从这一些举措来看,无疑是利好具有一定技术储备及实力的优秀仿制药企业的。
二是提升仿制药质量疗效。
加快推进仿制药质量和疗效一致性评价工作,细化落实鼓励企业开展一致性评价的政策措施;提高药用原辅料和包装材料质量,开展相关标准制修订,加强研发,突破提纯、质量控制等关键技术;提高工艺制造水平,推动解决制约产品质量的瓶颈问题;深化药品审评审批制度改革,优化审评审批流程。完善注册申请标准,提高仿制药质量安全水平和上市审评审批效率;加强药品质量监管,加快建立覆盖仿制药全生命周期的质量管理和质量追溯制度,严肃查处数据造假、偷工减料、掺杂使假等违法违规行为。
别看涉及面较多,归根到期其实就是生产、审批、质量安全的问题。这也说明,未来一致性评价有望随着临床资源瓶颈破除、医疗机构及医务人员临床试验积极性提高而快速推进,同时仿制药也将实行优先审评审批制度。
三是要完善支持政策,推动高质量仿制药尽快进入临床使用。
具体而言,及时将仿制药纳入采购目录,启动采购程序,促进质量和疗效一致的仿制药与原研药平等竞争;将质量和疗效一致的仿制药纳入与原研药可相互替代药品目录,在说明书、标签中予以标注,强化药师在药品调配中的作用;加快制定医保药品支付标准,与原研药质量和疗效一致的仿制药和原研药按相同标准支付,促进仿制药替代使用;明确药品专利实施强制许可路径,依法分类实施药品专利强制许可,鼓励专利权人自愿许可,必要时国家实施强制许可;落实税收优惠政策和价格政策,鼓励地方结合实际出台支持仿制药转型升级的政策措施;加快药品研发、注册、上市销售的国际化步伐,支持企业开展国际产能合作,建立跨境研发合作平台,推动仿制药产业国际化。
这五大具体的细则,从进采购目录到生产、研发、使用,都是为了提高质量,要求国际化,同时通过提升国产仿制药品质,实现降低国外原研药产品的进口需求,进而进行市场替代,从而达到医保控费的目的。换句话说“谁有技术、有质量,谁就能优先纳入采购目录”。
综合这三大点来讲,其实就是鼓励仿制药行业做大做强,属于长远的利好。
质量、安全不达标那就改革
国务院多次下发仿制药“改革措施”,这究竟是为啥?其实,多年来,中国制药行业一直保持在“仿制药大国”的现状。上世纪90年代,仿制药即占到国内化学药品生产的97%,直到现在,国内大多数药企仍集中于仿制药领域。
智通财经APP窥探其因,除了我国药企新药研发的基础薄弱和实力不济等因素外,人口老龄化、城镇化加速以及医保体系的不断健全,使作为医保品种核心的仿制药在整体用药中的比例长期居高不下,市场庞大,令药企难以割舍该业务与市场。
虽然作为“仿制药大国”,但与印度相比,其无论是质量、安全有效均存在较大的差距。与此同时,由于原研药价格昂贵,医保也负担不了,一来一去,那就从内部找原因,改革提质量。
2012年2月13日,国务院印发《国家药品安全“十二五”规划》,明确要求对2007年修订的《药品注册管理办法》实施前批准的仿制药,分期分批与被仿制药采取质量一致性评价,进行“历史的补课”。
政策是出了,可惜仍不给力。于是,2015年8月,国家下发《关于改革药品医疗器械审评审批制度的意见》,不仅提出了明确的评价原则,更是对基药目录内的化药品种设定了评价时间。随后,CDE也开始积极召集检验人才,扩充队伍。
不过,面对成千上万个申请数据,CDE压的有点透不过气。
2016年4月,国务院再次“坐不住”了,下发《国务院办公厅关于开展仿制药质量和疗效一致性评价的征求意见稿》;5月25,CFDA发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号),明确289个必须于2018年年底前完成一致性评价的化学药品仿制药口服固体制剂品种及其相应的规格。
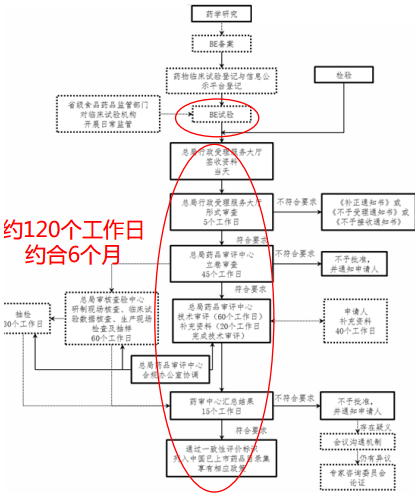
要求提出至今已悄然过去了20个月,也就是说,留个化学仿制药口服固体制剂品种离一致性评价的时间仅剩下8个月。智通财经APP了解到,一整套流程下来,没有个大半年你别想,除非你的某些数据能直接用上或走绿色通道(申请BE豁免),最关键点在于参比制剂与BE临床试验。
直到2017年12月29日,CFDA才将首批已通过的药品名单放出来,首批通过的品种总共有17个,涉及7家药企。
如A股的华海药业一人就占了9名额;海正药业的联营公司海正辉瑞凭借治疗原发性高血压、合并高血压的2型糖尿病肾病,不同规格的厄贝沙坦片拿到3个名额;信立泰也靠预防动脉粥样硬化血栓形成的硫酸氢氯吡格雷片拿到一个名额。
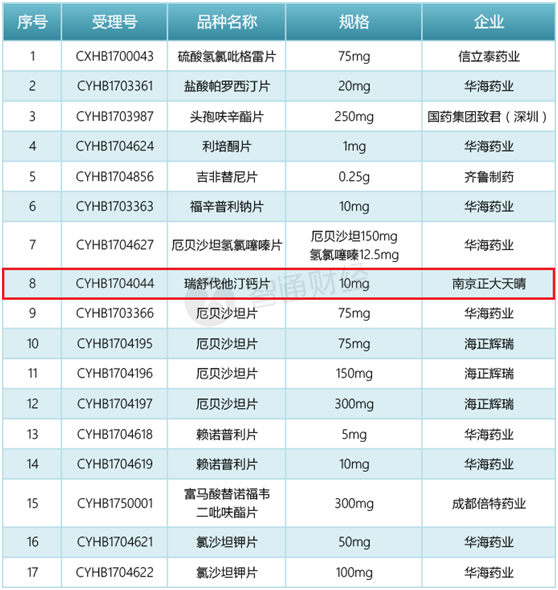
相比A股企业的热闹,港股仅有中国生物制药因其附属公司正大天晴的瑞舒伐他汀钙片抢得先机。
为何说是中国生物制药抢占了先机,因为在一致性评价政策一下,药企们手中的多半“现金牛”仿制药产品都必须得重新面临再做临床数据、等效试验。而一刀下去,竞品将全都处于同一起跑线,换句话说,谁先通过评审,谁便将再次获得市场。
首先,通过了的品种将在招标过程中享有“优先”权利。细看全国招标风向标的安徽模式,发展至今,一般药品(政策限制如妇儿科用药、急抢救用药、基础输液、低价药、谈判药品和精麻药品以外)仍旧是“双信封”制度,也就是说技术(质量)审核后,还需商务(报价)审核,优质价低的产品才能会中标。
但通过一致性评价的品种因为砸质量上更具有优势,所以在技术审核时得分会高于其他为通过的同类产品,打破了原先“唯低价是取”的规则,无形中增加了中标机会。
其次,优先通过的企业将取得稳定了“竞争”格局。因为从《关于仿制药质量和疗效一致性评价工作有关事项的公告》可以看到,假如同一品种有3家企业获得了通过,在药品集中采购时将自动淘汰那些未通过的品种,如此一来,有利于恢复良好的竞争次序。
选票就得挑项目多的企业
正因优势显著,各家企业也是积极参与。截至2017年7月,在参比制剂备案上,有5320条企业参比制剂申报备案情况,其中基药达2890条,占比54%,非基药2430条,占比46%。白云山(00874)、复星医药、石药为前三甲备案企业。
CFDA参比制剂目录,截止2017年7月21日,CFDA已发布八批共628个品种参比制剂信息,289基药品种参比制剂共231条,占比44%,非289品种共297条,占比56%。
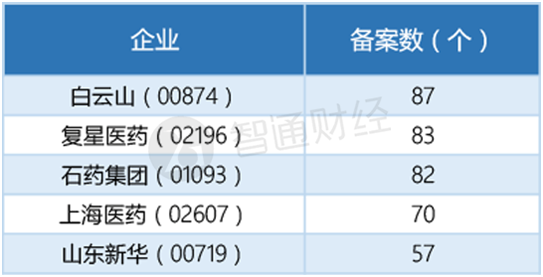
同时,BE临床试验登记方面,上述企业也处于领先地位。2017年上半年的BE备案品种数据显示,首仿药为主的公司有中国生物医药;上海医药、复星医药、 白云山、联邦制药(03933)等多为普药。
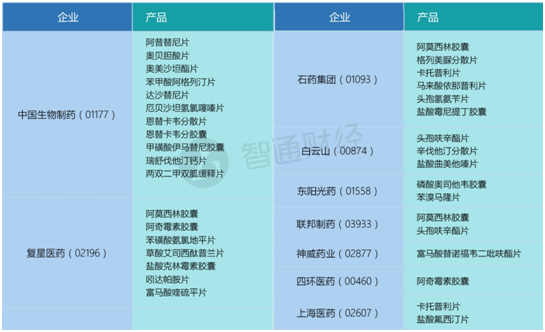
大道至简,复星医药、石药、白云山、东阳光药等将大有机会成为成港股仿制药的又一赢家。以复星医药来说,2017年除新并购的 Gland Pharma 外,该公司在研新药、仿制药、生物类似药及一致性评价等项目 171 项,其中一致性评价项目39 项。并在2018年初,该公司的苯磺酸氨氯地平片成功通过仿制药一致性评价。
结合新政的春风以及仿制药一致性评价的进程,的确综合实力越大、手握品种越多的药企,越容易迎来爆发。(田宇轩/文)



 扫码下载智通APP
扫码下载智通APP