从南京传奇的传奇,看细胞疗法的冰与火之歌
本文来自“E药经理人”微信公众号,作者为“一姐”。
区别于资本和相关企业对于CAR-T的热烈追逐,诸多科研学界人士始终对于CAR-T细胞治疗保持谨慎态度,不可否认的是CAR-T细胞治疗目前在安全性、商业化、实体瘤治疗以及监管等方面面临较多挑战,尤其是细胞因子风暴(CRS)或许并未引起足够的重视。
一直保持火热的CAR-T疗法近日又成为了医药行业的焦点。作为近年来被认为癌症治疗领域最成功的方法之一,以CAR-T为代表的细胞免疫疗法备受推崇,国内制药企业所上的CAR-T疗法临床试验呈现井喷之势。
3月13日,CDE公布了《细胞治疗产品申请临床试验药学研究和申报资料的考虑要点》(以下简称《要点》),继2017年12月CFDA颁布《细胞治疗用产品的研究与评价技术指导原则》之后,这是为按照药品研发的细胞治疗类产品提供规范性文件和申报路径。
同日,金斯瑞生物科技(01548)发布公司公告,旗下子公司南京传奇的CAR-T疗法LCAR-B38M 获CFDA的临床试验批件,成为我国首个获批临床的CAR-T疗法。该消息一出,为CAR-T又带了一波热度,金斯瑞股价也一度上涨近10%。
2017年12月11日,南京传奇的LCAR-B38M CAR-T细胞自体回输制剂在中国递交临床申请并获CFDA受理。三个月之后,成功获得临床试验批件,与此同时,其母公司金斯瑞的股价飙升超过250%。南京传奇自身就成为了传奇。
竞相入局,迅猛生长
2017年,无论是在全球还是国内医药市场,在CAR-T细胞免疫疗法领域都是获得巨大突破的一年,产业界和投资界都争相入局这一行业新宠。
在国内,南京传奇生物科技公司是该领域的典型代表。2017年6月,在美国临床肿瘤学会(ASCO)大会上,南京传奇公布了试验嵌合抗原受体CAR-T细胞疗法治疗复发性难治性多发性骨髓瘤的数据,成为来自中国的大黑马,一鸣惊人。
2017年12月11日,南京传奇的LCAR-B38M CAR-T细胞自体回输制剂在中国递交临床申请并获CFDA受理。仅7天后,CDE公布的44个拟纳入优先审评程序药品注册申请中,LCAR-B38M的新药临床申请在列。当前LCAR-B38M已获得临床批件。
在全球,诺华、Kite的CAR-T疗法先后获批上市。2017年8月31日,全球第一款CAR-T药物上市,FDA批准诺华的Kymriah用于治疗3至25岁的B细胞急性淋巴性白血病复发或不符合标准治疗的患者。随后于2017年10月18日,吉利德旗下Kite制药的Yescarta获FDA批准用于两次治疗失败后的成人B细胞淋巴瘤患者。
据了解,CAR-T细胞疗法目前主要应用的两类适应症为儿童和年轻成人急性淋巴细胞白血病和非霍奇金淋巴瘤。据预测,CAR-T疗法在我国存量市场空间约为228亿元至285亿元,考虑CAR-T疗法渗透率,我国每年新增血液瘤的市场空间总计约185亿元。但是更被看中的是,迅猛发展的CAR-T细胞疗法的更新换代能力以及未来更为广阔的治疗领域。
2018年1月29日,CDE公布第26批拟纳入优先审评程序的药品注册申请,在39个入选药品中CAR-T疗法占了3个席位,分别是银河生物的抗CD19分子嵌合抗原受体修饰的自体T淋巴细胞注射液、上海恒润达生的抗人CD19 T细胞注射液和上海科济生物的靶向磷脂酰肌醇蛋白多糖-3嵌合抗原受体修饰的自体T细胞。一系列规范性指导文件的出台以及多个CAR-T疗法纷纷纳入优先审评资格,似乎都在预示着国内CAR-T商业化进程的加快。
而资本界也早已嗅到全球和国内的市场和政策环境为CAR-T带来的红利,2017年,除去已上市的西比曼生物,科济生物、南京传奇、上海吉凯基因、艺妙神州、博生吉医药科技、恒润达生等涉足CAR-T领域的生物公司均受到资本的关注和青睐。其中,艺妙神州新一轮融资达5000万元。该领域的资本热似乎目前仍在升温,3月8日,药明康德旗下上海药明巨诺获得来自淡马锡、红杉资本中国基金和元明资本等知名投资机构的9000万美元A轮融资。
诺华和吉利德两大跨国制药大佬的背书,资金的涌入,政策的落地和利好,催生国内CAR-T行业进入新的热潮,越来越多的中国企业在积极布局。
据美国Clinical Trials数据显示,目前来自中国登记开展的CAR-T临床研究项目151项,在数量上超过欧洲,仅次于美国。在国内,据不完全统计,CFDA目前受理了约13个CAR-T细胞治疗临床申请,安科生物、恒润达生、复星医药等都在积极布局。但从审批进程来看,除了金斯瑞完成技术审评外,其他尚未开始评审或处于评审的过程中。
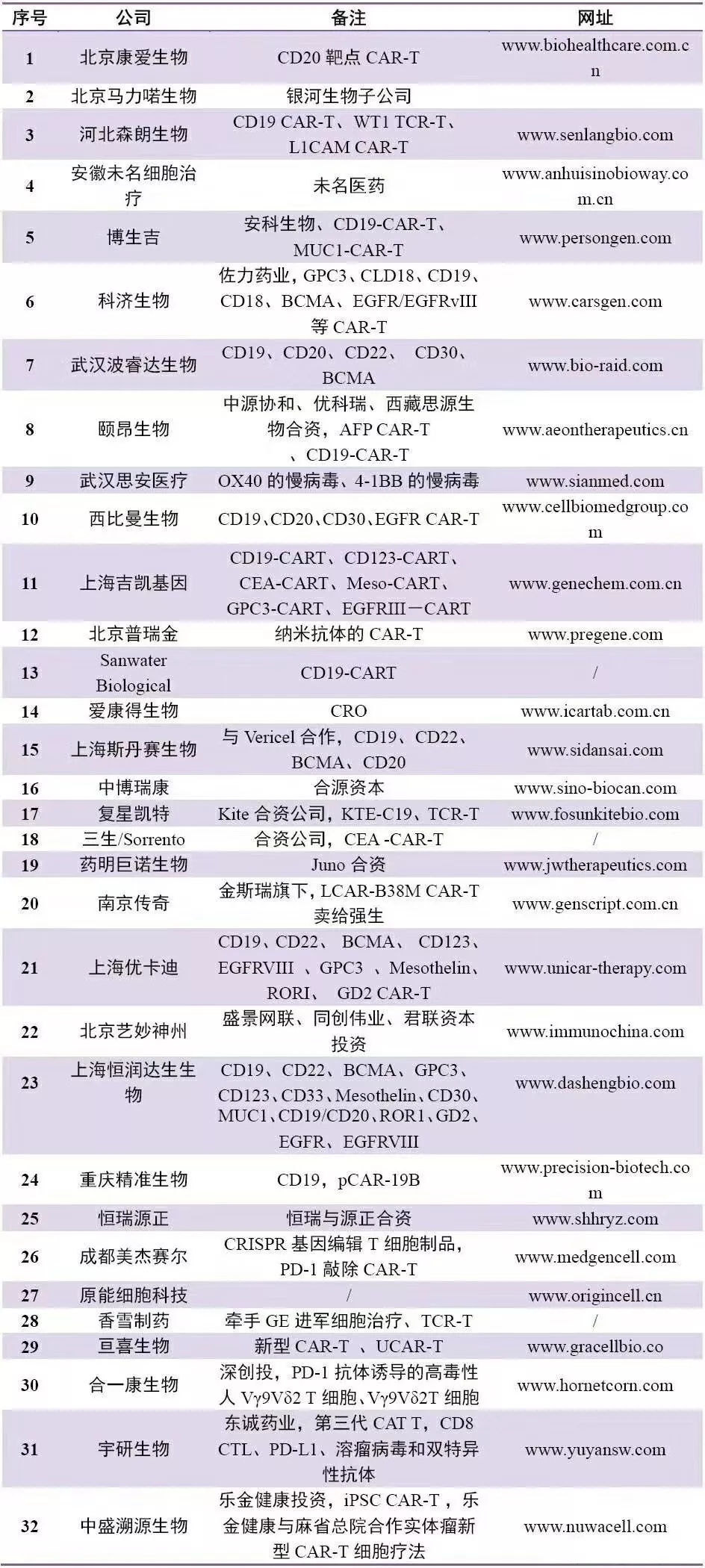
布局CAR-T的中国企业
安全性如何保证?标准在哪里?
CAR-T在癌症治疗领域给病患者带来巨大生存希望,尽管临床上被大量证实有效,但CAR-T技术的安全性始终是埋在科学家心头的一根刺。专业人士介绍,CAR-T疗法在技术层面仍然面临着细胞因子风暴(CRS)、神经毒性、脱靶效应等毒副作用以及实体瘤效果不佳等问题,虽然通过技术的不断优化改进这些问题有望被缓解,但其安全可控性依然是值得注意的问题。
CDE的《要点》就指出,CAR-T细胞产品属于“活”的细胞药物,且不能耐受病毒灭活/终端灭菌处理,产品本身具有高度的“个性化”和“异质性”,生产工艺与质量控制具有较强的“复杂性”和“特殊性”。按照药品研发与申报,已受理申报资料的完整性、规范性、溯源性及质量体系和风险控制要求存在较多缺陷,影响审评进度。即使是首家申报临床的南京传奇,据悉在2018年1月完成了药理毒理、临床和药学3项技术审评后,2月所有程序倒回,重新回到待审评状态,补充材料后才于3月初再次完成审评。
据悉,CAR-T临床研究最大的障碍在于严重的不良反应,其中细胞因子风暴(CRS)最为严重。接受CAR-T临床试验的患者的死亡率突显临床方案设计改进的和新药开发监管的必要性。细胞因子风暴是指体液中短时间内出现大量细胞因子的现象,是一种严重的过度免疫应答,会引发急性呼吸窘迫综合症和多器官衰竭等严重后果。

诺华、Kite和Juno在CAR-T疗法产品研发上均处于领先地位,但即使是行业标杆,在临床试验中也出现了不良反应甚至致死的情况。
诺华的产品Kymriah获批上市时,FDA便将CRS列为Kymriah的黑框警告。同时,FDA也扩大批准了罗氏的tocilizumab的适应症,用于对抗CAR-T疗法导致的严重CRS。
Juno的JCAR015疗法用于治疗复发性或难治性B细胞急性淋巴细胞白血病,在2016年就因出现5例在治疗患者因脑水肿死亡而最终叫停,事发一年后,Juno发现死亡原因是患者的个体差异特征与“产品变异性”,并将此次事故所的经验用于目前正在进行的临床试验中。
在CAR-T领域也备受关注的法国新锐公司Cellectis,其在研明星产品UCART123在针对急性髓系白血病(AML),以及母细胞性浆细胞样树突细胞肿瘤(BPDCN)的两项I期临床试验中出现一死一伤。2017年9月4日,FDA也因此暂停这两项试验的开展。而两个月后,Cellectis宣布FDA允许UCART123的两项I期临床试验继续进行。
CAR-T疗法的审评审批在跟进,但后续的标准的完善和监管是否能跟上也是一个问题。此前引发全社会轰动的“魏则西事件”,该事件中使用的是DC-CIK细胞疗法,不同于CAR-T疗法。但是,此前由于长期以来国内在细胞治疗上缺乏严格的技术监管和临床评价方法,以及肿瘤患者的持续增加,加上这类技术本身技术难度不高,受利益驱动在大量医院通过医院和公司合作的方式广泛开展。CIK、DC-CIK治疗甚至在不少省份被纳入医保,加剧了这些“无效”治疗被滥用状况。
专家分析,从监管角度看,CAR-T制备和临床研究是主要关注的问题。制备问题包括CAR-T产品的一致性、患者依赖的T细胞转染效率、适宜CAR转染的最佳T细胞类型以及CAR-T标记。临床研究主要关注效力和安全性。
除去安全性,价格也是悬在带来巨大希望的细胞疗法头上的大问题。CAR-T疗法因为其复杂的制备工艺和高昂的生产成本,也许无法成为大多数人挽救生命的希望。目前,已经在美国获批的两个产品,Kymriah用于治疗儿童和年轻成人(2~25岁)的急性淋巴细胞白血病(ALL),定价47.5万美元。Yescarta用于治疗特定类型大B细胞淋巴瘤,定价37.3万美元。而市场预测,如果上市,CAR-T疗法在国内的市场价格约为40万元~50万元/疗程。(编辑:王梦艳)



 扫码下载智通APP
扫码下载智通APP